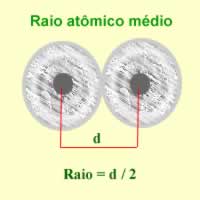
O raio atômico pode ser definido como a metade da distância entre dois núcleos atômicos. O texto Raio Atômico mostra como esse raio varia em relação a átomos de elementos químicos de uma mesma família e de um mesmo período da Tabela Periódica.

Mas o raio atômico também sofre variação quando eles realizam ligações químicas. Por exemplo, a ligação iônica ocorre quando há transferência definitiva de elétrons entre os átomos, sendo que pelo menos um deles perde elétrons enquanto o outro ganha.
O átomo que perdeu elétrons torna-se um cátion, que é um íon com carga positiva. Nesse caso, o raio atômico diminui. Por outro lado, quando o átomo ganha elétrons, ele torna-se um ânion (íon com carga negativa) e seu raio atômico aumenta.
Veja um exemplo: consideremos a ligação iônica entre os átomos do alumínio e do cloro, com formação do cloreto de alumínio (AℓCℓ3).
O alumínio no estado fundamental possui número atômico (Z = prótons) igual a 13, que é a mesma quantidade de elétrons. Mas ao realizar a ligação com três átomos de cloro, ele perde 3 elétrons para cada um, ficando com 10 elétrons e com carga 3+, ou seja, torna-se o cátion Aℓ3+. Abaixo temos a distribuição eletrônica do alumínio no estado fundamental e depois que se forma o cátion:

Observe que no estado fundamental o alumínio está com três camadas eletrônicas, enquanto, como cátion, ele deixa de ter a terceira camada e fica apenas com duas. Portanto, o seu raio atômico diminuiu.
Agora veja o que acontece com o cloro. Ele possui número atômico igual a 17 e, portanto, no estado fundamental, também possui 17 elétrons distribuídos em três camadas ou níveis eletrônicos. Cada átomo de cloro precisa ganhar um elétron para ficar com oito elétrons na última camada e ficar estável, segundo a teoria do octeto. Por isso, cada um dos tres átomos de cloro recebe um dos elétrons que o alumínio perdeu e fica com 18 elétrons, formando o ânion 7Cℓ1-:

Note que, como ânion, a quantidade de elétrons aumenta e, por isso, há uma expansão do nível. A repulsão elétrica aumenta em relação ao núcleo e os elétrons se afastam, passando a ocupar um espaço maior; por isso, o raio aumenta.
Resumidamente, temos:
Raio do cátion < Raio do átomo < Raio do ânion
Quando analisamos íons isoeletrônicos, ou seja, que possuem a mesma quantidade de elétrons e a mesma quantidade de camadas eletrônicas, o tamanho do raio atômico será menor quanto maior for a quantidade de prótons, isto é, do número atômico.
Por exemplo, como vimos, o cátion 13Aℓ3+ possui 10 elétrons em duas camadas. O cátion 12Mg2+ também possui 10 elétrons em duas camadas. Mas o raio atômico do magnésio será maior que o do alumínio, porque o alumínio possui mais prótons no núcleo e, portanto, a atração núcleo/último nível de energia é maior, tendo uma maior força de atração, o que diminui o raio atômico.
Agora consideremos a ligação covalente, que é formada pelo compartilhamento de pares eletrônicos. Se os átomos que realizam a ligação covalente forem do mesmo elemento, temos o chamado raio covalente, que é exatamente a metade do comprimento da ligação (d), isto é, metade da distância que separa os dois núcleos.
No entanto, no caso de ligações covalentes entre átomos de elementos químicos diferentes, o comprimento ou distância (d) será a soma dos raios covalentes (r1 + r2) dos átomos envolvidos na covalência, e o raio covalente do átomo pode variar dependendo à qual átomo ele se ligou. Veja um exemplo abaixo: