Existem inúmeras reações orgânicas ocorrendo separadamente ou simultaneamente em nosso corpo e na natureza. Atualmente também, muitos químicos em laboratórios de escolas, de universidades, de institutos de pesquisas ou de indústrias, estão envolvidos na obtenção de compostos orgânicos por meio de reações químicas. Assim, vários componentes essenciais para o nosso dia a dia, como os polímeros e os medicamentos, são obtidos por meio de reações orgânicas.
No entanto, as reações orgânicas normalmente demandam mais tempo e energia para ocorrerem do que as reações inorgânicas. Isso ocorre porque as reações inorgânicas são iônicas, isto é, ocorrem entre íons que estão “prontos” para reagir de forma espontânea, fácil e rápida.
Já as reações orgânicas são moleculares, o que significa que é necessário que haja a quebra de ligações das moléculas iniciais e a formação de novas ligações, que irão se encontrar nas moléculas finais. Por isso, elas são mais lentas e difíceis.
É oportuno lembrar também que, embora sejam numerosas, as principais reações orgânicas seguem padrões bem definidos, podendo-se prever o caminho e o resultado dessas reações. Além disso, elas seguem as leis gerais da Química, como as seguintes: moléculas polares reagem, em geral, melhor que as apolares, ácidos reagem com bases, oxidantes reagem com redutores etc.
As reações orgânicas podem ser classificadas de várias formas; mas alguns dos tipos principais são: substituição, adição e eliminação. Veja um pouco do que se trata cada caso:
1. Reações de Substituição:
Nesse tipo de reação ocorre a troca de um átomo (ou grupo de átomos) que faz parte do composto orgânico por outro átomo (ou grupo de átomos).
Esquematizando de maneira genérica, temos:
? ?
? C ? A + BX → ? C ? B + AX
? ?
Esse tipo de reação ocorre geralmente em alcanos, aromáticos, derivados do benzeno e em haletos orgânicos. Alguns exemplos de substituição são a halogenação, a nitração, a sulfonação, a alquilação e a acilação.
Exemplo de halogenação de um alcano:
H H
? ?
H? C ? H + Cl ? Cl → H ? C ? Cl + H? Cl
? ?
H H
METANO CLORO MONOCLOROMETANO CLORETO DE HIDROGÊNIO
Veja que nessa reação de monocloração do metano, um dos hidrogênios desse composto foi substituído por um halogênio (cloro).
2. Reações de adição:
Ocorrem quando se adiciona um reagente a uma molécula orgânica.
As reações de adição são características de compostos insaturados, isto é, que possuem ligações duplas ou triplas entre carbonos, como os alcinos, os alcenos e os alcadienos. Nesses casos a ligação pi (?), que é mais fraca, é rompida, permitindo assim que os elétrons que eram compartilhados entre os átomos de carbono passem a ser compartilhados com átomos de outros elementos “adicionados” à molécula, numa ligação simples.
Caso genérico:
A B
? ? ? ?
? C ? C ? + AB → ? C ? C ?
? ?
Podem-se adicionar ao composto orgânico átomos de hidrogênio, de halogênios, de haletos de hidrogênio e de água.
Veja um exemplo de reação de adição de hidrogênio em um alceno (eteno), produzindo um alcano (etano):
H H H H
? ? ? ?
H ? C ? C ?H + H2 → H ? C ? C ? H
? ?
H H
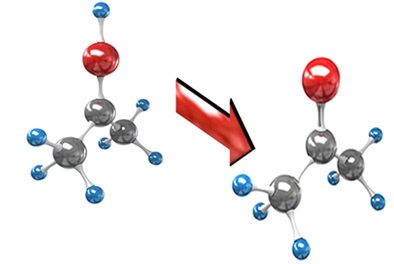
3. Reações de eliminação:
São aquelas em que, partindo-se de um composto orgânico, obtêm-se outros dois, um orgânico e um inorgânico. Pode ser uma reação de eliminação intramolecular (intra = dentro), ou seja, a própria molécula elimina alguns de seus átomos; ou intermolecular (inter= entre, no meio), onde duas moléculas do composto orgânico interagem unindo-se e eliminando determinado grupo de átomos.
Genericamente, temos:
Eliminação intramolecular:
A B
? ? ? ?
? C ? C ? → ? C ? C ? + AB
? ?
Eliminação intermolecular:
? ? ? ?
? C ? AB +BA ? C ? → ? C ? A ? C ? + AB2
? ? ? ?
Entre as reações de eliminação temos: desidratação intramolecular e intermolecular dos álcoois, desidratação de ácidos carboxílicos, eliminação de haletos orgânicos, de hidrogênios, e de halogênios.
A seguir temos uma reação orgânica de eliminação de um haleto orgânico, o brometo de hidrogênio do brometo de t-butila, produzindo metilpropeno. Essa reação ocorre com participação de um álcool como catalisador e aquecimento:
Br H
? ?
H3C ? C ? CH2 + KOH→ KBr+ HOH+ H3C ? C ? CH2
? ?
CH3 CH3
Aproveite para conferir nossa videoaula sobre o assunto: