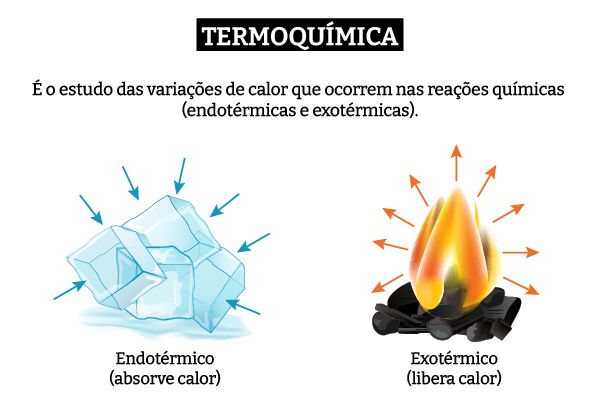
Termoquímica é a área da Química que investiga as trocas de calor envolvidas nas reações químicas e nos processos físicos. Esse campo é fundamental para entender como a energia se comporta em diferentes transformações, classificando os processos em exotérmicos e endotérmicos, conforme o calor é liberado ou absorvido.
Essas trocas de calor estão associadas à entalpia, uma medida da energia total de um sistema em condições de pressão constante. A variação de entalpia (ΔH) quantifica a energia liberada ou absorvida em uma reação, sendo negativa para processos exotérmicos (ΔH < 0) e positiva para endotérmicos (ΔH > 0). Por meio dessa variação, podemos calcular com precisão o calor trocado em processos químicos e físicos.
Leia também: A segunda lei da termodinâmica e o estudo da entropia
Tópicos deste artigo
- 1 - Resumo sobre termoquímica
- 2 - Videoaula sobre termoquímica
- 3 - O que é termoquímica?
- 4 - Fórmulas da termoquímica
- 5 - Tipos de reações termoquímicas
- 6 - Equação termoquímica
- 7 - O que é entalpia?
- 8 - Lei de Hess
- 9 - Termoquímica no cotidiano
- 10 - Qual a importância da termoquímica?
- 11 - Exercícios resolvidos sobre termoquímica
Resumo sobre termoquímica
-
Termoquímica é a área que estuda as variações de calor que ocorrem nas reações químicas.
-
A principal fórmula da termoquímica é o da variação de entalpia, ΔH = Hprodutos − Hreagentes.
-
As reações termoquímicas podem ser classificadas em exotérmicas (ΔH < 0) e endotérmicas (ΔH > 0).
-
A equação termoquímica é uma representação detalhada de uma reação química que inclui tanto os reagentes e produtos quanto a variação de entalpia (ΔH).
-
Entalpia é a medida da quantidade total de energia liberada ou absorvida pelo sistema durante um processo a pressão constante.
-
A lei de Hess se baseia no princípio de que o ΔH depende apenas do estado inicial e final dos reagentes e produtos, independentemente do caminho percorrido pela reação.
-
A termoquímica está presente em diversas reações do cotidiano, como na formação da fotossíntese e na queima de combustíveis.
-
A termoquímica é fundamental em diversos contextos, pois fornece o conhecimento necessário para manipular as trocas de energia em reações químicas, possibilitando uma ampla gama de aplicações.
Videoaula sobre termoquímica
O que é termoquímica?
A termoquímica é o ramo da Química dedicado ao estudo das trocas de calor que ocorrem durante as reações químicas e processos físicos. Esse campo envolve conceitos fundamentais de calor e temperatura, essenciais para compreender as mudanças de energia observadas nas reações.
Calor, em termoquímica, é a energia transferida entre o sistema e o ambiente devido a uma diferença de temperatura. Já a temperatura é uma medida da energia cinética média das partículas de um sistema, e não indica diretamente o calor trocado, mas influencia a direção da troca energética.
Para estudar essas trocas, a termoquímica analisa o sistema — o conjunto de substâncias reagentes e produtos — e o ambiente ao redor. A transferência de calor entre sistema e ambiente modifica a energia interna do sistema, influenciando suas propriedades e o curso das reações.
Em uma reação exotérmica, por exemplo, o calor é transferido do sistema para o ambiente, diminuindo a energia interna do sistema. Já em uma reação endotérmica, o sistema absorve calor do ambiente, aumentando sua energia interna. Essas trocas de calor podem ocorrer em sistemas abertos, fechados ou isolados, dependendo das condições de interação com o ambiente, como mostra a imagem a seguir.
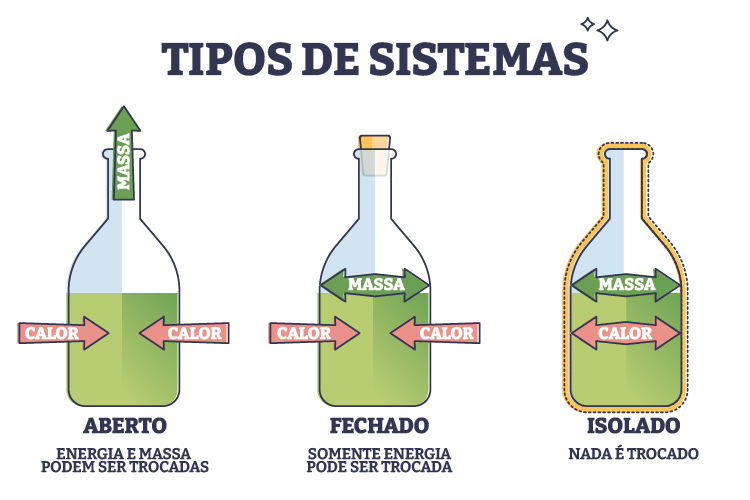
Em sistemas abertos, há trocas de calor e matéria; em sistemas fechados, apenas calor; enquanto em sistemas isolados, não há troca de calor ou matéria. Esse estudo detalhado das transferências de calor e energia permite que a termoquímica seja aplicada em áreas como Engenharia, Biologia e Meteorologia, em que os princípios de troca de energia influenciam a eficiência de processos industriais, a manutenção de organismos e as mudanças climáticas.
Veja também: Como saber se uma reação química é endotérmica ou exotérmica?
Fórmulas da termoquímica
Na termoquímica, algumas fórmulas são essenciais para o cálculo das trocas de calor. Entre elas, a mais utilizada é a fórmula da variação de entalpia (ΔH), dada por:
ΔH = Hprodutos − Hreagentes.
Em que H representa a entalpia, e a diferença entre a entalpia dos produtos e dos reagentes indica se a reação é exotérmica (ΔH < 0) ou endotérmica (ΔH > 0). Esse cálculo é útil para determinar a quantidade de calor liberado ou absorvido em uma reação, principalmente em processos em pressão constante, como as reações que ocorrem em ambientes laboratoriais ou industriais.
Outra expressão comum é a relação entre calor (q) e variação de temperatura (ΔT) para substâncias específicas:
\(q= m\cdot c \cdot \Delta T\)
Em que:
m → massa do material
c → calor específico (quantidade de calor necessária para aquecer 1 grama da substância em 1 °C)
ΔT → variação de temperatura
Essa fórmula é útil para calcular o calor necessário para aquecer ou resfriar substâncias em processos práticos.
Tipos de reações termoquímicas
As reações termoquímicas são classificadas em exotérmicas e endotérmicas, de acordo com a forma como trocam calor com o ambiente. Essa classificação é baseada na energia envolvida durante o processo químico: nas reações exotérmicas, o sistema libera calor para o ambiente, enquanto, nas reações endotérmicas, o sistema absorve calor.
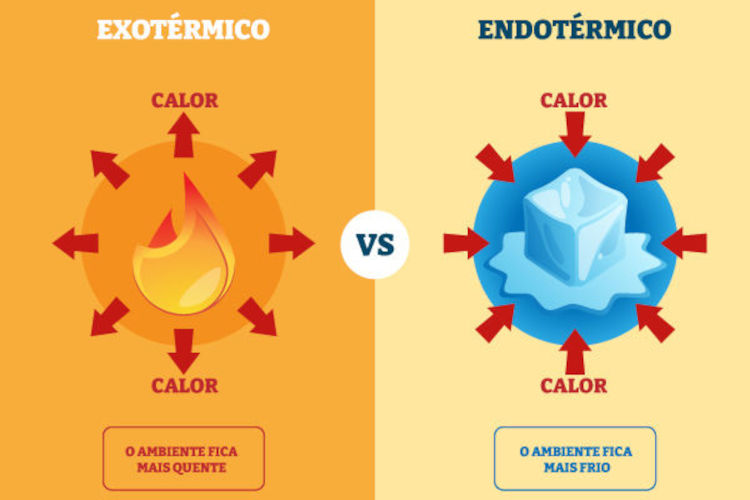
Entender essas classificações permite reconhecer como a energia se comporta nas transformações químicas, ajudando a prever o comportamento das substâncias e as variações energéticas observadas.
→ Reações exotérmicas
Nas reações exotérmicas, a energia dos produtos é menor que a energia dos reagentes, indicando que parte da energia armazenada nas ligações químicas foi liberada na forma de calor. Como resultado, o ambiente ao redor do sistema é aquecido. Esse processo é representado matematicamente por uma variação de entalpia negativa (ΔH < 0), pois houve liberação de energia.
Um gráfico de energia para uma reação exotérmica ilustra essa mudança: no eixo vertical, temos a energia dos reagentes e dos produtos; no eixo horizontal, o progresso da reação. Inicialmente, a energia dos reagentes é mais alta. Durante a reação, a energia atinge um pico — a chamada “energia de ativação” necessária para iniciar o processo — e, em seguida, decai para um nível mais baixo nos produtos, como mostra o gráfico a seguir.
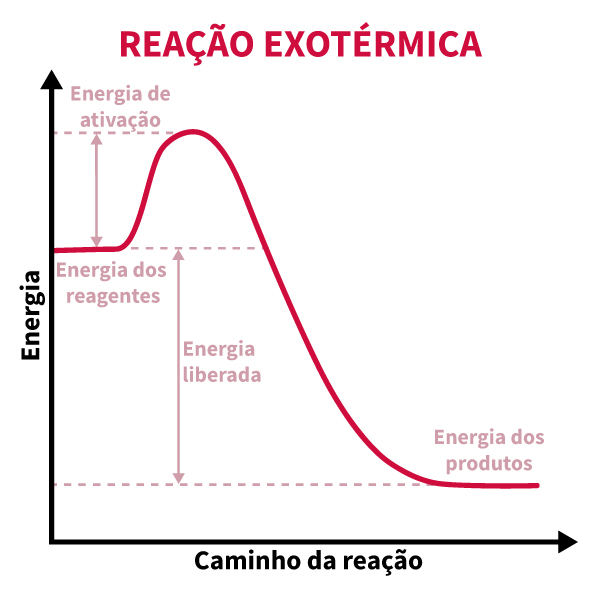
O gráfico mostra uma “queda” na energia total, o que representa a energia liberada para o ambiente, tornando ΔH negativo. Esse comportamento indica a espontaneidade de muitas reações exotérmicas, que frequentemente ocorrem de forma natural, como na queima de combustíveis e na digestão de alimentos.
→ Reações endotérmicas
Nas reações endotérmicas, ocorre o oposto: o sistema absorve energia do ambiente para que a reação aconteça. Isso significa que a energia dos produtos é maior do que a energia dos reagentes, pois o sistema retém o calor absorvido. Nesse caso, a variação de entalpia é positiva (ΔH > 0), já que o sistema ganha energia.
Em um gráfico de energia para uma reação endotérmica, a energia dos produtos é mostrada mais alta do que a dos reagentes, como mostra o gráfico a seguir.
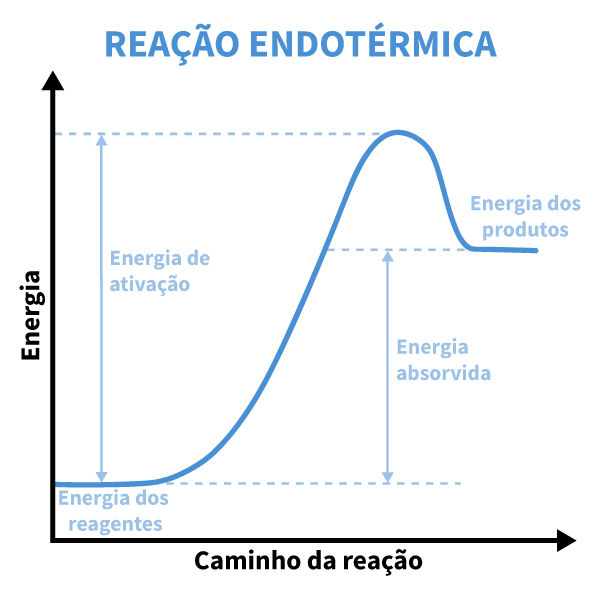
O gráfico começa com a energia inicial dos reagentes, que atinge um pico devido à energia de ativação e, em seguida, mantém-se em um nível superior nos produtos. Esse “aumento” na energia total ilustra a absorção de calor pelo sistema, justificando a variação positiva de entalpia (ΔH > 0). Esse processo não é espontâneo e requer um fornecimento contínuo de energia.
Equação termoquímica
A equação termoquímica é uma representação detalhada de uma reação química que inclui tanto os reagentes e produtos quanto a variação de entalpia (ΔH), ou seja, a quantidade de calor liberada ou absorvida pelo sistema. Esse tipo de equação é essencial para a termoquímica, pois mostra a energia envolvida nas transformações, permitindo que cientistas e engenheiros calculem a eficiência energética de processos químicos e industriais.
Uma equação termoquímica pode representar reações exotérmicas e endotérmicas, dependendo se há liberação ou absorção de calor. No caso das reações exotérmicas, o valor de ΔH é negativo, indicando que o sistema perdeu energia para o ambiente. Já nas reações endotérmicas, o valor de ΔH é positivo, pois o sistema absorveu energia.
→ Exemplo de equação termoquímica para uma reação exotérmica
Considere a combustão de glicose, uma reação exotérmica muito comum:
C6H12O6(s) + 6O2 → 6CO2(g) +6H2O(l) ΔH = -2800 kJ
Nessa reação, a glicose (C6H12O6) reage com o oxigênio (O2) para formar dióxido de carbono (CO2) e água (H22O), liberando 2800 kJ de energia. O sinal negativo de ΔH indica que se trata de uma reação exotérmica, na qual o calor é liberado para o ambiente.
Essa reação pode ser representada de duas formas alternativas, destacando o valor de entalpia (ΔH) ao lado dos produtos ou dos reagentes, como demonstrado a seguir:
-
Colocando o valor de entalpia no lado dos reagentes:
C6H12O6(s) + 6O2 - 2800 kJ → 6CO2(g) +6H2O(l)
Essa representação indica que 2800 kJ de energia são liberados no decorrer da reação, estando “subtraídos” do lado dos reagentes para enfatizar que não estão mais no sistema ao final da reação.
-
Colocando o valor de entalpia no lado dos produtos:
C6H12O6(s) + 6O2 → 6CO2(g) +6H2O(l) + 2800 kJ
Aqui, a energia liberada é apresentada ao lado dos produtos, representando o calor que é liberado para o ambiente como um “produto” adicional da reação.
Essas duas notações são alternativas para representar a mesma informação termoquímica. Em ambos os casos, o valor de ΔH negativo confirma que a reação é exotérmica, e o calor gerado é uma indicação da eficiência energética do processo, o que é relevante em contextos como combustão em motores e processos de aquecimento industrial.
→ Exemplo de equação termoquímica para uma reação endotérmica
Em uma reação endotérmica, o sistema absorve calor do ambiente, o que eleva a energia total dos produtos em comparação com a dos reagentes. Um exemplo de reação endotérmica é a redução do óxido de ferro (III) com carbono:
Fe2O3(s) + 3C(s) → 2Fe(s) + 3CO(g) ΔH = +491,5 kJ
Nessa reação, o óxido de ferro (Fe2O3) reage com o carbono (C) para formar ferro metálico (Fe) e monóxido de carbono (CO), absorvendo 491,5 kJ de energia. O sinal positivo de ΔH mostra que essa reação requer calor para ocorrer, caracterizando-a como endotérmica.
Como no exemplo anterior, a entalpia pode ser expressa ao lado dos reagentes ou dos produtos para destacar que o sistema precisa absorver calor:
-
Colocando o valor de entalpia no lado dos reagentes:
Fe2O3(s) + 3C(s) + 491,5 kJ → 2Fe(s) + 3CO
Essa representação indica que a energia de 491,5 kJ é necessária para que a reação ocorra, sendo adicionada aos reagentes para completar a transformação.
-
Colocando o valor de entalpia no lado dos produtos:
Fe2O3(s) + 3C(s) → 2Fe(s) + 3CO(g) - 491,5 kJ
Aqui, o calor absorvido é mostrado ao lado dos produtos com sinal negativo, representando que a energia absorvida é retirada do ambiente para ser adicionada ao sistema e permitir que a reação ocorra.
O que é entalpia?
Entalpia é uma grandeza termodinâmica que representa o conteúdo total de energia de um sistema, incluindo sua energia interna e o trabalho necessário para manter seu volume e pressão constantes. Essa energia é fundamental para compreender a termoquímica, pois permite medir as trocas de calor entre um sistema e seu ambiente em reações químicas e processos físicos que ocorrem em pressão constante, como mostra a fórmula abaixo.
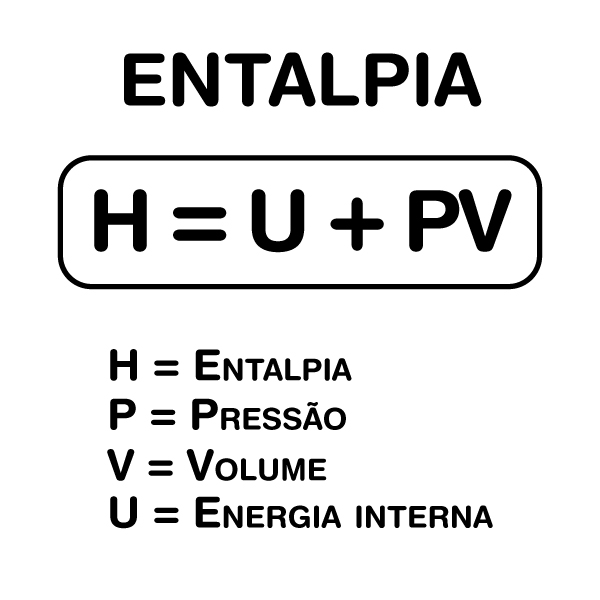
Para expressar a mudança de entalpia durante um processo, utilizamos a variação de entalpia (ΔH), que reflete a quantidade de calor absorvida ou liberada em uma reação química. Essa variação é frequentemente medida em joules (J) ou quilojoules (kJ), mas também em calorias (cal) ou quilocalorias (kcal), dependendo do contexto.
A relação entre a entalpia e a energia do sistema permite que cientistas determinem se uma reação é endotérmica (ΔH > 0) ou exotérmica (ΔH < 0).
→ Fatores que alteram o valor da entalpia
A entalpia de um sistema pode variar conforme alguns fatores que influenciam a quantidade de energia presente nos reagentes e produtos. Entre esses fatores, estão:
-
Quantidade de reagentes e produtos: a quantidade de substâncias afeta diretamente o valor de ΔH. Quanto maior a quantidade de reagentes, maior será a variação de entalpia total da reação. Por exemplo, em uma reação como a combustão de metano, dobrando a quantidade de metano e oxigênio, dobramos também a energia liberada.
-
Temperatura: a temperatura afeta a energia interna das moléculas e, consequentemente, a entalpia. Em geral, em temperaturas mais altas, as moléculas têm mais energia cinética, o que pode alterar as condições de reação.
-
Estado alotrópico: certos elementos podem existir em formas alotrópicas distintas, como o oxigênio (O2) e o ozônio (O3). Cada forma tem uma energia de formação diferente e, portanto, apresenta entalpias distintas.
-
Fases de agregação das substâncias (estados físicos): as diferentes fases (sólido, líquido e gás) de uma substância também influenciam a entalpia. A transição entre fases requer ou libera energia, o que é essencial para cálculos termoquímicos precisos. Por exemplo, a energia necessária para vaporizar água líquida é adicionada ao sistema, aumentando o valor de ΔH.
→ Entalpia padrão
A entalpia padrão refere-se à entalpia de uma reação medida sob condições padrão (pressão de 1 atm e temperatura de 25 °C ou 298 K). Esses valores padronizados são essenciais para garantir que os valores de ΔH possam ser comparados entre diferentes reações e substâncias. Abaixo, exploramos alguns dos tipos mais importantes de entalpias padrão e seus exemplos.
-
Entalpia padrão de formação (ΔHf°): é a variação de entalpia envolvida na formação de 1 mol de uma substância por meio de seus elementos em suas formas alotrópicas mais estáveis, sob condições padrão. Esse conceito é fundamental para determinar a energia necessária para a formação de compostos por meio de substâncias elementares. Exemplo: A formação de água com base em hidrogênio e oxigênio pode ser representada pela seguinte equação:
\(H_2(g) + \frac{1}{2}O_2(g) \rightarrow H_2O(l) \ \ \Delta H^º_f = -285,8 kJ/mol\)
Esse valor negativo de ΔHf° indica que a reação de formação da água é exotérmica, ou seja, libera calor para o ambiente.
-
Entalpia padrão de combustão (ΔHc°): é a variação de entalpia na combustão completa de 1 mol de uma substância em condições padrão. Essa entalpia é especialmente útil para avaliar a quantidade de energia liberada por combustíveis, como hidrocarbonetos, amplamente utilizados como fonte de energia. Exemplo: A combustão do etanol, que libera calor, pode ser expressa pela seguinte reação:
C2H5OH(l) + 3O2(g) → 2CO2(g) +3H2O(g) ΔHc° = -1367 kJ/mol
O valor negativo de ΔHc° confirma que a combustão do etanol é um processo exotérmico, liberando 1367 kJ/mol de energia para o ambiente. Essa reação de combustão é um exemplo de como os hidrocarbonetos liberam grandes quantidades de energia, sendo essenciais em aplicações industriais e energéticas.
→ Entalpia de ligação
A entalpia de ligação é a quantidade de energia necessária para quebrar 1 mol de ligações de uma molécula no estado gasoso. Esse conceito é importante, pois a quebra e a formação de ligações químicas são etapas fundamentais em qualquer reação. Em geral, a entalpia de ligação é positiva, uma vez que a quebra de ligações requer energia.
Exemplo: A quebra da ligação em uma molécula de cloro gasoso é um processo endotérmico, expresso pela seguinte reação:
Cl2(g) → 2Cl(g) ΔH = +242 kJ/mol
O valor positivo de entalpia indica que essa reação absorve 242 kJ para quebrar 1 mol de ligações Cl–Cl, sendo necessário fornecer energia ao sistema para que essa separação de átomos ocorra.
Lei de Hess
A lei de Hess é um princípio fundamental da termoquímica que afirma que a variação de entalpia total de uma reação depende apenas do estado inicial e final dos reagentes e produtos, independentemente do caminho percorrido para que a reação ocorra. Em outras palavras, o calor liberado ou absorvido em uma reação química é o mesmo, independentemente das etapas intermediárias. Esse conceito é particularmente útil para calcular a entalpia de reações que não podem ser medidas diretamente.
→ Cálculo do ΔH pela lei de Hess
Para determinar a variação de entalpia (ΔH) de uma reação pela lei de Hess, somamos as variações de entalpia das reações intermediárias de modo que a reação final desejada seja obtida. Isso envolve reorganizar e manipular as equações intermediárias de forma que, ao somá-las, eliminemos as espécies intermediárias e fiquemos apenas com os reagentes e produtos finais.
Vamos aplicar a lei de Hess para calcular a entalpia de formação do propano (C3H8) com base em carbono grafite e hidrogênio gasoso:
3C (graf.) + 4H2(g) → C3H8(g)
Para calcular ΔH dessa reação, utilizaremos as seguintes reações auxiliares com seus respectivos valores de entalpia:
-
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l) ΔH = -2220 kJ/mol
-
C (graf.) + O2(g) → CO2(g) ΔH = -394 kJ/mol
-
\(H_2(g) + \frac{1}{2}O_2(g) \rightarrow H_2O(l) \ \ \Delta H = -286 kJ/mol\)
Nosso objetivo é reorganizar essas reações de modo que, ao final, tenhamos apenas os reagentes e produtos da reação que queremos resolver.
-
Passo 1 - Análise das equações dadas: para encontrar o ΔH da formação de C3H8, começamos identificando as substâncias comuns nas reações fornecidas. A primeira reação (I) descreve a combustão do propano, produzindo CO2 e H2O, e fornece o valor de ΔH da combustão. As reações (II) e (III) descrevem a formação de CO2 e H2O com base em seus elementos, com os valores de entalpia padrão dessas formações.
-
Passo 2 - Manipulação das reações: para obter a reação desejada, precisamos inverter a reação de combustão do propano descrita na reação (I), já que a reação de formação que buscamos vai na direção oposta.
1°) Invertemos a reação (I):
3CO2(g) + 4H2O(l) → C3H8(g) + 5O2(g) ΔH = +2220 kJ/mol
Aqui, ao invertermos a reação, também invertemos o sinal de ΔH, de -2220 kJ/mol para +2220 kJ/mol.
-
2°) Multiplicamos a reação (II) por 3:
\(3(C\ (graf.)\ + \ O_2 (g) \rightarrow CO_2(g)) \implies 3C\ (graf.) +3O_2(g) \ \ \Delta H =3x(-394) = -1182kJ\)
Essa etapa garante que temos três moles de CO2, necessários para que possamos cancelá-los com a reação de combustão inversa.
-
3°) Multiplicamos a reação (III) por 4:
\(4(H_2(g) + \frac{1}{2}O_2(g) \rightarrow H_2O(l)) \implies 4H_2(g) +2O_2(g) \rightarrow 4H_2O(l) \ \ \Delta H = 4x(-286) = -1144 kJ\)
Esse ajuste fornece quatro moles de H2O, correspondentes ao lado esquerdo da reação invertida da combustão do propano.
-
Passo 3 - Somando as reações: agora somamos as reações ajustadas para obter a reação final, e, cancelando as espécies comuns nos dois lados, obtemos:
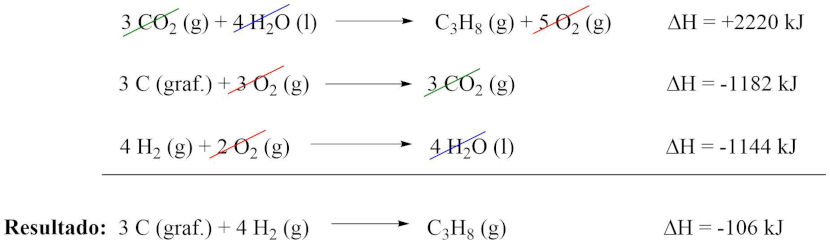
A variação de entalpia total (ΔH) é a soma das entalpias das reações modificadas:
ΔH = +2220 kJ + (-1182 kJ) + (-1144 kJ) = -106kJ
Portanto, a entalpia de formação do propano, ΔH, é -106 kJ. Esse valor negativo indica que a formação do propano com base em carbono grafite e hidrogênio gasoso é um processo exotérmico, liberando energia.
Termoquímica no cotidiano
A termoquímica está presente em diversas reações do cotidiano, nas quais ocorrem transformações que envolvem trocas de energia. Um exemplo clássico é a fotossíntese, processo endotérmico que ocorre nas plantas. Nesse caso, a energia luminosa é absorvida para transformar dióxido de carbono e água em glicose e oxigênio, fundamentais para a nutrição e crescimento vegetal:
6CO2 + 6H2O + energia (luz) → C6H12O6 + 6O2
Outro exemplo comum é a queima de combustíveis, como a gasolina nos motores de veículos. A combustão é uma reação exotérmica que libera uma grande quantidade de energia na forma de calor e gases, gerando o movimento do motor:
C8H18 + 12,5O2 → 8CO2 + 9H2O + energia
No cotidiano, podemos perceber a natureza endotérmica ou exotérmica de um processo observando se há uma mudança de temperatura. Por exemplo, ao tocar um cubo de gelo, sentimos frio porque ele absorve calor das nossas mãos para derreter, caracterizando um processo endotérmico. Em contraste, as reações exotérmicas, como a combustão, liberam energia, produzindo calor.
Outro exemplo menos evidente é a dissolução de certos sais em água. Por exemplo, o nitrato de amônio, usado em bolsas de gelo instantâneas para lesões esportivas, absorve calor do ambiente ao se dissolver, produzindo uma sensação de frio e funcionando como um resfriador portátil.
No entanto, há também processos exotérmicos não tão óbvios. A formação de ferrugem, por exemplo, é uma reação exotérmica. Embora lenta, a oxidação do ferro libera pequenas quantidades de calor ao longo do tempo.
Esses fenômenos são importantes porque mostram que as trocas de energia ocorrem em muitos processos cotidianos e podem até ser manipuladas em tecnologias práticas, como bolsas térmicas e sistemas de combustão. Assim, fica claro que a termoquímica é uma parte fundamental do cotidiano, em que processos que absorvem ou liberam energia regulam muitos aspectos de nossas vidas.
Qual a importância da termoquímica?
A termoquímica é fundamental em diversos contextos, pois fornece o conhecimento necessário para manipular as trocas de energia em reações químicas, algo crucial para uma ampla gama de aplicações. No corpo humano, por exemplo, a termoquímica explica como as reações metabólicas, como a respiração celular, liberam energia essencial para a realização de atividades vitais. Sem essas reações, o corpo não teria a energia necessária para funções básicas, como movimento e regulação da temperatura corporal.
No cotidiano, a termoquímica também é essencial em processos que envolvem aquecimento e resfriamento. Nas residências, o uso de fogões e aquecedores envolve a queima de combustíveis, em que o calor gerado por essas reações exotérmicas é usado para cozinhar e aquecer ambientes.
Outro exemplo é o uso de baterias, que armazena energia química para ser liberada na forma de eletricidade, um processo que depende de reações exotérmicas controladas. Na indústria, o conhecimento termoquímico é aplicado na produção de materiais e energia. A fabricação de cimento, por exemplo, exige a calcinação do calcário em altas temperaturas, um processo endotérmico que consome grande quantidade de energia.
Em contraste, a indústria petroquímica explora reações exotérmicas para produzir energia por meio de combustíveis fósseis. Entender e controlar essas reações é essencial para otimizar processos industriais e minimizar custos, além de permitir a criação de produtos químicos com propriedades específicas.
Assim, a termoquímica é uma área essencial da ciência que afeta desde a saúde e o conforto diário até a eficiência e inovação nos processos industriais.
Saiba mais: O que é a energia térmica?
Exercícios resolvidos sobre termoquímica
Questão 1 (Enem) Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
C6H12O6(s) + 6 O2(g) → 6CO2(g) + 6 H2O (l) ΔcH = -2800 kJ
CH3CH(OH)COOH (S) + 3 O2 (g) + 3 H2O (l) ΔcH = -1344 kJ
O processo anaeróbico é menos vantajoso energeticamente porque
A) libera 112 kJ por mol de glicose.
B) libera 467 kJ por mol de glicose.
C) libera 2 688 kJ por mol de glicose.
D) absorve 1 344 kJ por mol de glicose.
E) absorve 2 800 kJ por mol de glicose.
Resposta: A)
Resolução: A questão aborda um problema da lei de Hess, em que se usa reações intermediárias para se chegar ao valor de entalpia de um processo específico.
Primeiro, é importante considerar que a reação que deve ser formada é a do processo anaeróbio, e, segundo o texto, esse processo ocorre com a formação de duas moléculas de ácido láctico.
Outra coisa a ser considerada é que um processo anaeróbio ocorre sem a presença de oxigênio.
Dessa forma, manteremos a equação de combustão da glicose da mesma forma como foi dada, porque precisamos da glicose no lado dos reagentes:
C6H12O6 (s) + 6 O2 → 6 CO2 (g) + 6 H2O (l) ΔCH = -2800 kJ
Já a equação de combustão do ácido láctico será invertida, pois o ácido precisa estar no lado dos produtos. Atente-se ao fato de que, ao inverter a equação termoquímica, o valor da entalpia terá o sinal invertido também. Assim, o ΔH = -1344 kJ passará a ser ΔH = + 1344 kJ, como mostra a equação abaixo:
3 CO2 (g) + 3 H2O (l) → CH3CH(OH)COOH (s) + 3 O2 ΔCH = + 1 344 kJ
Além da inversão, a equação deverá ser multiplicada por 2, para garantir as duas moléculas de ácido láctico no lado dos produtos, conforme descreve o texto.
2 . [ 3 CO2 (g) + 3 H2O (l) → CH3CH(OH)COOH (s) + 3 O2 ΔCH = + 1 344 kJ]
Ao realizar essa multiplicação, todos os valores de coeficientes estequiométricos são multiplicados por 2, inclusive o valor de entalpia, que passa a ter o valor dobrado, como mostra o procedimento abaixo:
6 CO2 (g) + 6 H2O (l) → 2 CH3CH(OH)COOH (s) + 6 O2 ΔCH = +2688 kJ
Essa multiplicação também permitirá igualar as quantidades de oxigênio (O2), dióxido de carbono (CO2) e água (H2O), em lados opostos (reagente e produtos), nas duas reações, permitindo que ambos sejam cancelados do processo na hora de definir a equação geral.
C6H12O6 (s) + 6 O2 → 6 CO2 (g) + 6 H2O (l) ΔCH = -2800 kJ
6 CO2 (g) + 6 H2O (l) → 2 CH3CH(OH)COOH (s) + 6 O2 ΔCH = +2688 kJ
Na sequência, as duas reações são somadas e as substâncias que aparecem em lados opostos da seta, nas duas reações, são canceladas. Os valores de entalpia também são somados para dar a o valor de entalpia da reação formada, como mostra abaixo:
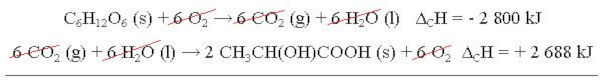
C6H12O6 (s) + 6 O2 → 2 CH3CH(OH)COOH (s) ΔCH = ₋112 kJ
Assim, temos que o processo anaeróbio ocorre com liberação de -112 kJ de energia.
Questão 2 (Enem) Um incêndio atingiu uma fábrica de resíduos industriais em Itapevi, na Grande São Paulo. O local armazenava três toneladas de fosfeto de alumínio. De acordo com a Companhia Ambiental do Estado de São Paulo (Cetesb), o fosfeto de alumínio reagiu com a água usada para apagar as chamas, produzindo hidróxido de alumínio e fosfina.
A fosfina é um gás tóxico, incolor, e não reage com a água, porém reage rapidamente com o oxigênio liberando calor e produzindo pentóxido de difosfóro. Segundo os médicos, a inalação do pode causar queimadura tanto na pele quanto nas vias respiratórias devido à formação de ácido fosfórico
Os gráficos 1, 2 e 3 representam a variação da energia em função do caminho da reação para três transformações químicas, sendo o reagente e o produto de cada reação.
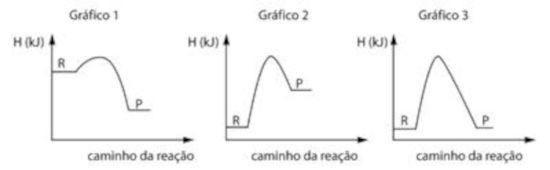
Entre os gráficos 1, 2 e 3, aquele que representa corretamente a reação da fosfina com o oxigênio, descrita no texto, é o
A) gráfico 1, pois a reação é endotérmica e apresenta ΔrH° < 0.
B) gráfico 1, pois a reação é exotérmica e apresenta ΔrH0° < 0.
C) gráfico 2, pois a reação é endotérmica e apresenta ΔrH° > 0.
D) gráfico 2, pois a reação é exotérmica e apresenta ΔrH0° < 0.
E) gráfico 3, pois a reação é endotérmica e apresenta ΔrH° > 0.
Resposta: B)
Resolução: De acordo com o texto, a reação da fosfina com o oxigênio libera calor. Isso significa que o processo é exotérmico (ΔrH0° < 0).
Também é importante considerar que, em uma reação exotérmica (ΔrH0° < 0), os reagentes apresentam entalpia maior do que os produtos, indicando que a reação é espontânea. Por isso, a reação ocorre com a liberação de energia para o ambiente.
Já o processo endotérmico (ΔrH0° > 0) é o oposto, apresenta entalpia dos produtos maior que a dos reagentes, indicando que o processo não é espontâneo e, por isso, precisa absorver energia do ambiente para poder ocorrer.
Analisando os gráficos, vemos que:
O gráfico 1 representa uma reação exotérmica, que libera calor. Isso condiz com a reação da fosfina.
O gráfico 2 representa uma reação endotérmica, que absorve calor, em que a energia dos produtos é maior que a dos reagentes, indicando que o processo ocorre com absorção de energia. Isso não condiz com a reação descrita no texto.
O gráfico 3 representa uma reação em que os reagentes e produtos apresentam a mesma energia. Isso também não condiz com a reação sofrida pela fosfina com o oxigênio.
Dessa forma, o gráfico que melhor representa a reação da fosfina com o oxigênio é o gráfico 1.
Fontes
ATKINS, Peter; JONES, Loretta; Princípios de química: questionando a vida moderna e o meio ambiente; 3ª ed.;Porto Alegre; Bookman; 2006.
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1. 5 ed. Rio de Janeiro: LTC, 2003.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.