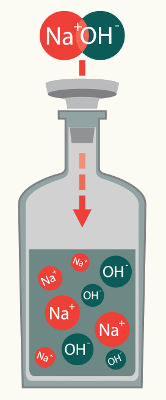
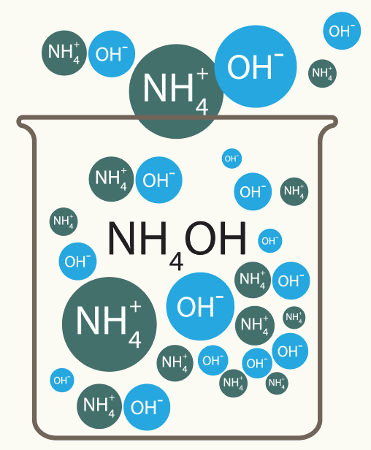
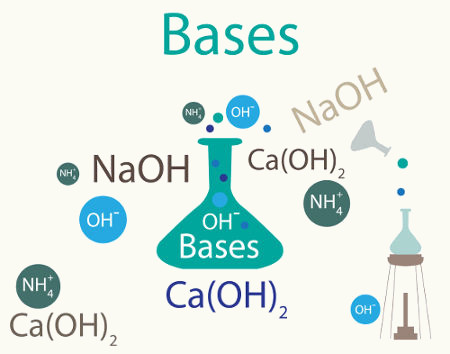
Bases inorgânicas são compostos iônicos que apresentam um metal (com exceção do hidróxido de amônio, NH4) ligado a um grupo hidroxila (OH). Porém, o fato de serem iônicas não quer dizer que elas tenham necessariamente boa solubilidade em água.
A solubilidade das bases está diretamente relacionada com a família periódica do metal ligado ao grupo hidroxila (OH). Assim, para conhecer o grau de solubilidade de uma base, é necessário conhecer a família do metal presente em sua fórmula.
Quanto à solubilidade, as bases podem ser classificadas em:
→ Solúveis:
Bases que apresentam uma excelente solubilidade em água. São solúveis apenas as bases que possuem metais alcalinos (IA) e o cátion amônio (NH4) em sua constituição. Os metais alcalinos são:
-
Sódio (Na)
-
Potássio (K)
-
Rubídio (Rb)
-
Césio (Cs)
-
Frâncio (Fr)
Abaixo seguem alguns exemplos de fórmulas de bases solúveis:
-
Hidróxido de sódio (NaOH)
-
Hidróxido de potássio (KOH)
-
Hidróxido de lítio (LiOH)
→ Pouco solúveis:
Bases que apresentam uma pequena solubilidade em água. São pouco solúveis apenas as bases que possuem metais alcalinoterrosos (IIA) em sua constituição. Os metais alcalinoterrosos são:
-
Cálcio (Ca)
-
Estrôncio (Sr)
-
Bário (Ba)
-
Rádio (Ra)
OBS.: Os elementos Berílio e Magnésio pertencem à família dos metais alcalinoterrosos, mas a solubilidade de suas bases é mais baixa do que a de todos os outros elementos dessa família.
Abaixo seguem alguns exemplos de fórmulas de bases pouco solúveis:
-
Hidróxido de rádio [Ra(OH)2]
-
Hidróxido de bário [Ba(OH)2]
-
Hidróxido de cálcio [Ca(OH)2]
→ Praticamente insolúveis:
Bases que praticamente não se dissolvem em água. São praticamente insolúveis todas as bases que não apresentam metais alcalinos e alcalinoterrosos em sua constituição.
Abaixo seguem alguns exemplos de fórmulas de bases praticamente insolúveis:
-
Hidróxido de alumínio [Al(OH)3]
-
Hidróxido de prata (AgOH)
-
Hidróxido de ferro II [Fe(OH)2]
Conhecer a solubilidade de uma base é um passo importante para determinar sua capacidade de dissociação, já que solubilidade e dissociação são propriedades físicas que se inter-relacionam.
A dissociação (força) de uma base é a capacidade que ela tem de liberar íons em água. Se for uma base forte, ela liberará uma grande quantidade de íons em água; se for uma base fraca, liberará uma pequena quantidade de íons em água.
Assim, quanto maior a solubilidade de uma base, maior será sua tendência de liberar íons. Veja alguns exemplos de bases solúveis e pouco solúveis que não apresentam boa dissociação:
-
Hidróxido de amônio (NH4OH)
-
Hidróxido de berílio [Be(OH)2]
-
Hidróxido de magnésio [Mg(OH)2].
Videoaulas relacionadas: