Visto que raramente encontramos substâncias puras na natureza, fazem-se necessários processos de separação de misturas, especialmente nos laboratórios e nas indústrias químicas, em que se quer obter os componentes isolados dessas misturas.
Esse processo de separação de misturas recebe várias denominações: análise imediata, resolução, fracionamento ou desdobramento.
As misturas homogêneas são as mais difíceis de serem separadas, pois na maioria das vezes é imperceptível, até mesmo a nível microscópico, a quantidade de componentes nessas misturas.
Porém, os cientistas desenvolveram alguns métodos simples, baseados nas propriedades físicas das substâncias, que as diferenciam umas das outras. Propriedades como ponto de ebulição e solubilidade.
Vejamos alguns desses processos:
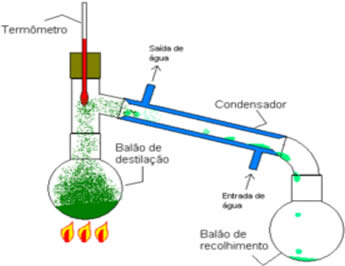
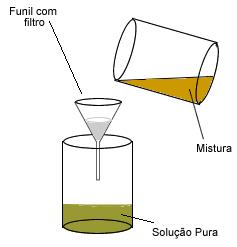
• Destilação simples: serve para separar sólidos em líquidos, como sal dissolvido na água. Seu princípio de funcionamento se baseia no fato de o líquido evaporar e o soluto não. Em laboratório, a aparelhagem que se utiliza está esquematizada abaixo:

A mistura homogênea está no balão de destilação, que é aquecido, e o líquido evapora, deixando no balão o sólido. O vapor passa pelo condensador e volta para o estado líquido, ao entrar em contato com as paredes dele que estão frias em razão da passagem contínua de corrente de água. O líquido condensado é coletado no erlenmeyer.
É um método bem eficaz, pois permite a separação completa, sem perder nenhum dos componentes da mistura.
• Destilação Fracionada: nesse caso a separação ocorre entre misturas de dois líquidos miscíveis, porém com pontos de ebulição diferentes. Seus pontos de ebulição não podem ser muito próximos.
O esquema é bem parecido com o anterior, porém com um detalhe diferente: a presença da coluna de fracionamento. Nela, o líquido que for menos volátil vai se condensar e voltar para o balão de fundo redondo. E o mais volátil irá ultrapassá-la e irá se liquefazer no condensador, sendo coletado em outro frasco.

• Liquefação Fracionada: são misturas de gases com pontos de ebulição diferentes. Lembrando que toda mistura de gases é homogênea. Por exemplo, o ar atmosférico é um conjunto de gases, em que os principais constituintes são o nitrogênio (N2), com cerca de 80%, e o oxigênio (O2), com 19 %, aproximadamente.
Nesse processo, um dos gases se torna líquido antes do outro, através da diminuição da temperatura e do aumento da pressão.
• Fusão Fracionada: processo semelhante ao anterior, porém, envolve misturas de sólidos com temperaturas de fusão diferentes. Ao se aquecer, o que tem menor ponto de fusão derrete ou se funde primeiro e, assim, é possível separá-lo do outro sólido.
• Cristalização e evaporação: separam-se sólidos dissolvidos em líquido, sendo que nesse líquido estão presentes outros sólidos dissolvidos. Esse processo é muito utilizado para separar o sal da água do mar. Pois ao se evaporar a água, o cloreto de sódio (sal de cozinha) é o último a ser obtido.
O aspecto negativo desse processo é a perda de um dos componentes. No exemplo acima, perde-se a água.
• Extração por solventes: adiciona-se a água a fim de se obter um dos líquidos que está misturado ao outro. Por exemplo, uma mistura com gasolina e álcool pode ser separada ao se adicionar água, pois o álcool se solubiliza na água e a gasolina não. Assim, separa-se inicialmente a gasolina. Depois, se quiser separar a água do álcool é só fazer a destilação fracionada.
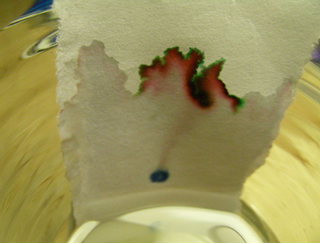
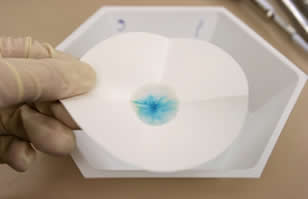
• Análise Cromatográfica ou Cromatografia: é feita para se separar os componentes de uma mistura de sólidos em solução. Eles são identificados pela cor.
Videoaula relacionada: