Na natureza existe uma grande diversidade de substâncias. Existem substâncias sólidas, líquidas, gasosas, que conduzem eletricidade, inertes e assim por diante. A variedade é imensa. Além disso, muitas dessas substâncias são capazes de enfrentar as intempéries do tempo, permanecendo inalteradas por milhões de anos, como no caso das que compõem as pirâmides do Egito e os ossos dos dinossauros.

A pirâmide e o osso de dinossauro permanecem por milhões de anos graças às ligações químicas
Essa diversidade e estabilidade das substâncias se devem ao fato dos elementos químicos possuírem a capacidade de se ligarem uns aos outros. Esse fenômeno foi denominado por Linus Pauling (1901-1994) de ligação química.
Pauling encontrou em 1920 um artigo de Gilbert Newton Lewis (1875-1946) que propunha uma teoria que explicava porque os átomos se mantinham unidos. Acontece que a grande maioria dos elementos não é encontrada na natureza na forma isolada, como vemos na Tabela Periódica. Por exemplo, não encontramos o sódio (Na) e o cloro (Cl) livres na natureza; no entanto, existem quantidades enormes de sal comum (NaCl), que é um composto formado pela união ou ligação química entre o sódio e o cloro.
Além disso, quando as ligações entre os átomos dos elementos são desfeitas, é liberada determinada quantidade de energia. Essas informações nos mostram que eles são mais estáveis ligados uns aos outros do que na forma isolada.
Os únicos elementos que são encontrados isolados na natureza de forma estável são os gases nobres, isto é, os elementos da família 18 ou VIII A (hélio (He), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn).

A diferença desses elementos para os demais é que eles possuem o último nível de energia (camada de valência) completo no estado fundamental. Isso significa ter 2 elétrons na camada de valência quando o elemento tiver apenas um nível (no caso do hélio), ou ter 8 elétrons na camada de valência quando o elemento tiver dois ou mais níveis de energia.

Com isso, pode-se concluir que os outros átomos atingem a estabilidade ao adquirir uma distribuição eletrônica externa semelhante à dos gases nobres.
Essa teoria foi enunciada pela primeira vez em 1916 por Walther Kossel (1888-1956) como teoria eletrônica de valência e mais tarde foi aperfeiçoada separadamente por Gilbert Newton Lewis (já citado) e por Irving Langmuir (1881-1957). Langmuir foi o criador do nome “regra do octeto”, pelo fato de a maioria dos gases nobres apresentarem 8 elétrons na camada mais externa. Essa regra ou teoria pode ser enunciada da seguinte forma:

É por isso que os átomos se ligam uns aos outros; pois através da perda ou ganho, ou ainda, do compartilhamento de elétrons na camada de valência eles atingem a configuração de gás nobre e ficam estáveis.
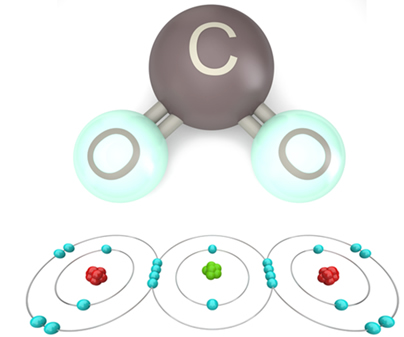
Veja por exemplo o caso da água, formada pela ligação de dois átomos de hidrogênio com um de oxigênio. O hidrogênio possui só uma camada e um elétron no estado fundamental; portanto, segundo a regra do octeto, cada átomo de hidrogênio precisa ganhar mais um elétron para ficar estável. Já o oxigênio possui seis elétrons na camada de valência; com isso, ele precisa ganhar 1 elétron para ficar estável. Como nos dois casos é preciso ganhar elétrons, não tem como um perder e outro ganhar, então eles vão compartilhar seus elétrons, estabelecendo uma ligação química, como mostra a figura abaixo. Veja que os hidrogênios ficam cada um com 2 elétrons (configuração eletrônica do hélio) e o oxigênio com 8 elétrons (configuração eletrônica do Ne):

É por isso que a água é um composto estável e abundante na natureza.
A regra do octeto não é aplicada para todos os elementos, ela explica principalmente as ligações entre os elementos representativos (famílias A). Porém, mesmo entre os elementos representativos existem muitas exceções*. Ainda assim, a teoria do octeto continua sendo usada porque ela explica as ligações químicas que formam a maioria das substâncias presentes na natureza.
* Veja o texto “Exceções à Regra do Octeto”.
Aproveite para conferir nossa videoaula sobre o assunto: