Uma das reações orgânicas de grande aplicação é a reação de adição de haletos de hidrogênio a alcenos, alcinos e alcadienos. Essas reações são importantes principalmente porque originam compostos que são usados na produção de muitos polímeros sintéticos importantes, como o PVC (policloreto de vinila).
Nessas reações, a ligação pi da molécula orgânica é rompida e os átomos do haleto de hidrogênio, que pode ser o cloreto de hidrogênio (HCl), o brometo de hidrogênio (Hbr) ou o iodeto de hidrogênio (HI), ligam-se aos carbonos que antes realizavam a ligação dupla.
Veja um exemplo de como isso ocorre no caso da hidro-halogenação do eteno:
H2C ═ CH2 + H ─ Cl → H2C ─ CH2
│ │
H Cl
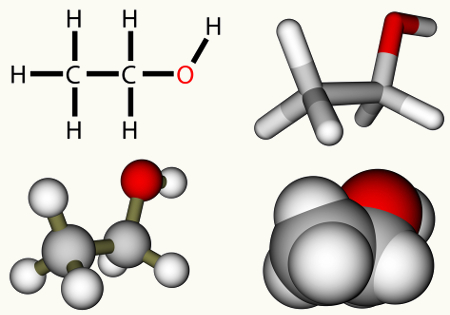
Outro tipo de reação de adição importante é a reação de hidratação, em que uma molécula de água se adiciona ao hidrocarboneto em meio ácido, produzindo álcoois. Veja a formação do etanol por meio da hidratação do eteno:
H2C ═ CH2 + H2O → H2C ─ CH2
│ │
H OH
O eteno é uma molécula simétrica, então, não faz diferença em qual carbono da dupla o hidrogênio, o halogênio (Cl, Br ou I) e a hidroxila (OH) ligam-se. Mas e se essas reações ocorressem com moléculas assimétricas, como o propeno? Observe a seguir que se formariam moléculas diferentes, dependendo do carbono em que os átomos estivessem ligados:
H2C ═ CH ─ CH3 + H ─ Cl → H2C ─ CH ─ CH3 ou H2C ─ CH ─ CH3
│ │ │ │
H Cl Cl H
E agora? Qual das duas moléculas se forma em maior quantidade?
O químico russo Vladimir Vasilyevich Markovnikov (1838-1904) passou a estudar algumas reações de adição de haletos de hidrogênio a alcenos e alcinos em 1869. Ele chegou à regra que leva o seu nome e que nos ajuda a determinar qual produto será formado em maior quantidade na prática. A regra de Markovnikov pode ser enunciada assim:
“Na adição de um haleto de hidrogênio a um alceno, o hidrogênio do haleto liga-se ao átomo de carbono mais hidrogenado da dupla, ou seja, ao átomo que possui mais ligações com o hidrogênio.”
Isso significa que no exemplo acima o produto principal será:
H2C ═ CH ─ CH3 + H ─ Cl → H2C ─ CH ─ CH3
│ │
H Cl
Observe que o hidrogênio do HCl liga-se ao carbono 1 (que é o da extremidade) porque ele é o carbono mais hidrogenado. Ele está ligado a dois hidrogênios, enquanto o outro carbono da dupla está ligado somente a um hidrogênio. Por isso, o cloro liga-se a ele.
Essa regra também se aplica no caso da adição da água. Veja:
H2C ═ CH ─ CH3 + H2O → H2C ─ CH ─ CH3
│ │
H OH
Os outros produtos também se formam, mas em uma quantidade inferior, por isso são produtos secundários.
Mas por que isso acontece?
Bem, tanto a molécula de água quanto as moléculas dos haletos de hidrogênio são polares. O hidrogênio fica com uma carga parcial positiva:
Hδ+ ─ Cl δ- e Hδ+ ─ OH δ-
Assim, esse hidrogênio terá a tendência de ligar-se ao carbono da dupla que estiver com o caráter negativo maior. Visto que o carbono é mais eletronegativo que o hidrogênio, quanto mais átomos de hidrogênio estiverem ligados ao carbono da dupla, mais negativo ele ficará. Por outro lado, se ele estiver ligado a outro carbono, eles possuirão a mesma eletronegatividade e o resultado será uma carga nula.

O carbono mais hidrogenado possui maior caráter negativo e, por isso, o hidrogênio liga-se a ele
Se formos mais à fundo na regioquímica dessa reação, veremos que ela passa, na verdade, por duas etapas, uma lenta e uma rápida. A etapa determinante da reação é a etapa lenta, em que o alceno doa um par de elétrons que estava sendo compartilhado na ligação pi para o próton (H+) do haleto, formando um carbocátion, que é uma molécula eletropositiva, e também um ânion do halogênio:

Formação do carbocátion na etapa lenta da reação
Por ter uma energia de ativação muito alta, essa etapa é lenta e é considerada determinante para a reação.
No caso do propeno, dois carbocátions poderiam ser formados, que seria um primário e um secundário:

Etapa lenta da reação de hidro-halogenação do propeno
O carbocátion secundário, em que a valência livre fica no carbono secundário ou no menos hidrogenado, é o mais estável, além de ser formado mais rapidamente. Isso ocorre porque a energia livre de ativação desse intermediário da reação é mais baixa, por isso, ele é formado preferencialmente.
Assim, na etapa rápida, o ânion haleto, que no exemplo acima é o Br-, liga-se ao carbono secundário, formando nosso produto majoritário:

Etapa rápida da reação de hidro-halogenação do propeno
Assim, o carbocátion mais estável fornece o produto mais estável, que será o produto principal da reação. Vendo por esse ângulo dos mecanismos das reações, a regra de Markovnikov pode ser enunciada mais corretamente da seguinte forma:
“A parte positiva do reagente liga-se por si só a um átomo de carbono da ligação dupla de tal forma que produza o carbocátion mais estável como um intermediário”.