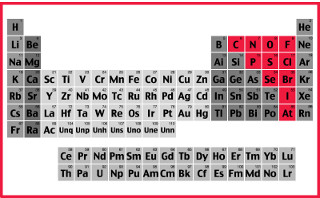
Conforme dito no texto Classificação dos Elementos Químicos, os ametais (ou não metais) correspondem aos onze elementos químicos mostrados na figura acima, isto é, carbono (C), nitrogênio (N), fósforo (P), oxigênio (O), enxofre (S), selênio (Se), flúor (F), cloro (Cl), bromo (Br), iodo (I) e astato (At).
Esses elementos participam de reações de oxirredução, nas quais ocorrem trocas de elétrons entre as espécies químicas. Essas reações são também chamadas de reações de simples troca ou deslocamento, pois uma substância simples (formada somente por um tipo de elemento químico) “desloca” da substância composta (formada por mais de um elemento) uma nova substância simples. Para entender melhor, temos o esquema genérico a seguir de como ocorre esse deslocamento:
A + BC → AB + C
Veja que A deslocou o elemento C da substância composta. Porém, para que esse tipo de reação realmente ocorra, é necessário que o ametal que forma a substância simples seja mais reativo que o ametal que está presente na substância composta.
A reatividade dos ametais corresponde à tendência que esses elementos possuem de ganhar elétrons e formar ânions (íons ou espécies químicas carregadas negativamente). Isso ocorre porque os não metais são elementos eletronegativos, isto é, têm elevada tendência de atrair os elétrons. Então, quanto maior a eletronegatividade do ametal, mais reativo ele é.
Por exemplo, digamos que coloquemos em contato o cloreto de potássio com o iodo:
KCl(aq) + I2(aq) → ?
Será que essa reação ocorrerá? Será que o iodo deslocará o cloro do cloreto de potássio (2 KCl(aq) + I2(aq) → 2 KI(aq) + Cl2(aq))?
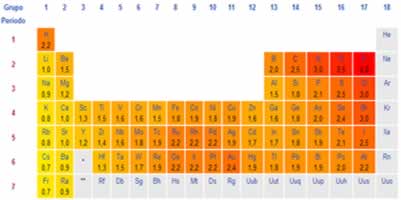
Essa reação ocorrerá somente se o iodo for mais reativo que o cloro. A ordem de reatividade dos ametais foi determinada experimentalmente por meio da medição da eletronegatividade dos elementos. Existem várias formas de medir a eletronegatividade, mas a forma mais conhecida e usada é a que foi determinada pelo cientista Linus Pauling, cujos valores estão mostrados na imagem a seguir:

Valores de eletronegatividade de Pauling na Tabela Periódica
Baseado nesses valores, criou-se até mesmo uma fila de eletronegatividade dos elementos mais eletronegativos que costumam ser mais trabalhados:
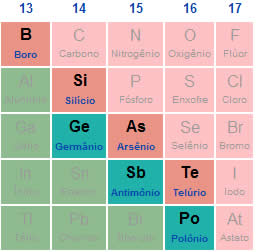
F > O > N > Cl > Br > I > S > C > P > H
Veja os valores das eletronegatividades desses elementos, respectivamente:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Apesar do hidrogênio não ser um ametal, é comum sua reatividade ser colocada nessa fila a título de comparação.
Existe uma espécie de “macete” para decorar essa fila de eletronegatividade, que é dada pela seguinte frase: “Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”. A letra inicial de cada palavra corresponde ao símbolo dos elementos na exata ordem em que aparecem na fila de reatividade.
Agora que já sabemos a ordem de reatividade dos ametais, podemos dizer se a reação entre o cloreto de potássio e o iodo ocorrerá. Observe que o iodo (eletronegatividade igual a 2,5) é menos reativo que o cloro (eletronegatividade igual a 3,0). Portanto, essa reação de simples troca não ocorrerá.
KCl(aq) + I2(aq) → NÃO OCORRE
Por outro lado, se fosse uma reação entre água de cloro e iodeto de potássio, a reação ocorreria, pois o cloro é mais reativo que o iodo e seria capaz de deslocá-lo. Veja:
2 KI(aq) + Cl2(aq)→2 KCl(aq) + I2(aq)
É possível visualizar a ocorrência dessa reação porque tanto a água de cloro quanto o iodeto de potássio formam soluções incolores. Mas quando elas são colocadas para reagir, observa-se a formação de uma coloração castanha em razão da formação do iodo.

Formação de precipitado de iodo em reação de oxirredução entre água de cloro e iodeto de potássio
Veja também o texto Reatividade dos Metais para aprender a determinar se as reações envolvendo esses elementos ocorrerão de fato.
Videoaula relacionada: