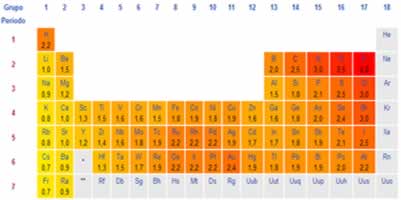
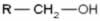Os haletos orgânicos são compostos que derivam de hidrocarbonetos. Neles, pelo menos um átomo de hidrogênio ligado a um carbono é substituído por um halogênio (elementos da família 17 ou VII A da tabela periódica):
Geralmente, os halogênios são representados pela letra X. Assim, seu grupo funcional é dado por:
X
│
─ C ─ , X = F, Cl, Br e I.
│
O astato (At) não aparece na indicação acima porque ele é um elemento radioativo, cujo isótopo mais estável tem meia-vida de pouco mais de oito horas, o que torna o seu aproveitamento muito difícil.
Os haletos orgânicos podem passar por reações de substituição orgânicas, isto é, o halogênio pode ser substituído por outro átomo ou grupo de átomos. Desse modo, esse tipo de reação pode ser utilizado na indústria química para a obtenção das mais diversas funções orgânicas. Dentre elas, podemos destacar como exemplo a obtenção de álcoois, em que o halogênio é substituído por uma hidroxila (OH).
Para tal, os haletos orgânicos sofrem hidrólise alcalina, ou seja, eles sofrem uma quebra quando são colocados na presença de uma solução aquosa de base forte, como o hidróxido de sódio (NaOH(aq)). Observe como isso ocorre a seguir:

Reação de substituição (hidrólise alcalina) do cloroetano para a formação de um álcool
Observe que há a formação do etanol e do ácido clorídrico. Mas ocorrem também reações inorgânicas pararelas, como a de neutralização entre a base (NaOH) e o ácido (HCl) com formação de um sal (NaCl) e água.
Conforme mostrado no texto Compostos Sulfurados ou Tiocompostos, o gás mostarda usado em guerras é um líquido volátil, extremamente tóxico e de odor semelhante à mistura de alho com mostarda. Esse gás é um tioéter de nome 2-cloroetilsulfanil-2-cloroetano, cuja fórmula estrutural é Cl- CH2-CH2-S-CH2-CH2-Cl.
Assim, quando ele entra em contato com a umidade do ar ou do organismo que o inala, ocorre uma reação de substituição parecida com a mencionada:
Cl ─ CH2 ─ CH2 ─ S ─ CH2 ─ CH2 ─ Cl + 2 H2O → HO─ CH2 ─ CH2 ─ S ─ CH2 ─ CH2 ─ OH + 2 HCl
O HCl formado é o que reage com a pele, olhos e sistema respiratório, podendo causar cegueira, edema pulmonar, lesões na pele (produz bolhas dolorosas em todo o corpo do atingido) e asfixia.
Outras funções que podem ser obtidas a partir de reações de substuição nos haletos são éter, alcino, cianeto (ou nitrila) e amina. Veja:
* Obtenção de éter: CH3 ─ Cl + NaOCH3 → CH3 ─ O─ CH3 + NaCl
* Obtenção de alcino:CH3 ─ Cl + NaC ≡ C ─ CH3 → CH3 ─ C ≡ C ─ CH3 + NaCl
* Obtenção de cianeto: CH3 ─ Cl + NaCN → CH3 ─ CN + NaCl
* Obtenção de amina: CH3 ─ Cl + NH3 → CH3 ─ NH2 + HCl
No entanto, os haletos orgânicos são compostos de preço elevado e, por isso, não são usados indiscriminadamente para produzir essas substâncias. Na realidade, esse tipo de reação possui seu uso limitado à produção de compostos de alto valor comercial, como medicamentos, corantes especiais e cosméticos.
Entre os quatro halogênios mencionados (F, Cl, Br e I), o mais reativo é o flúor, seguido do cloro, bromo e o iodo, que é, portanto, o menos reativo. Isso porque a reatividade dos halogênios aumenta com o aumento da eletronegatividade (força de atração sobre os elétrons da reação), e o flúor é o mais eletronegativo. Além disso, do iodo para o flúor, aumenta-se a energia da ligação C ─ X.
iodetos < brometos < cloretos < fluoretos
Agora, considerando várias moléculas de haletos orgânicos formadas pelo mesmo halogênio, a reatividade ou facilidade com que a reação de substituição ocorre é maior em haletos terciários, ou seja, que possuem o halogênio ligado a um carbono terciário (que está ligado a três outros carbonos), seguido do haleto secundário e, por último, do haleto primário.
haleto primário < haleto secundário < haleto terciário
Isso acontece porque, conforme pode ser observado a seguir, o caráter do carbono terciário é positivo (+1) e, visto que o oxigênio do grupo OH que forma o álcool pela substituição do halogênio é negativo, ele é mais fortemente atraído por esse carbono (cargas opostas atraem-se). Nos haletos secundários, o carbono possui carga igual a zero, e nos haletos primários, sua carga é -1, o que torna a reação ainda mais difícil.
.jpg)
Carga parcial dos carbonos