Reações de simples troca com ametais são fenômenos químicos em que uma substância composta (formada por um cátion e um ânion) é colocada em um mesmo recipiente que uma substância simples, formada obrigatoriamente por um ametal.
A principal característica de uma reação de simples troca é a mudança de posição entre os elementos de classificação ametálica. Nesse processo, o ametal (X) presente na substância composta (ZX) troca de lugar com o ametal (Y), que forma a substância simples. Ocorre, então, a formação de uma nova substância simples e uma nova substância composta:
ZX + Y → ZY + X
Porém, colocar para reagir substâncias com essa característica nem sempre quer dizer que obrigatoriamente ocorrerá a reação. Muito pelo contrário, a reação de simples troca com ametais somente acontece se o ametal da substância simples for mais reativo que o ametal da substância composta.
Para saber se um ametal é mais reativo que outro, basta conhecer a seguinte ordem decrescente de reatividade dos ametais, na qual o flúor é o elemento mais reativo e o hidrogênio é o menos reativo:
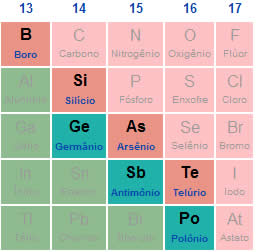
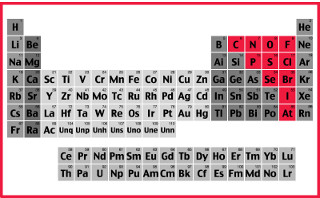
F > O > N > Cl > Br > I > S > C > P > H
Acompanhe a seguir alguns exemplos de equações que representam reações de simples troca entre ametais:
1º Exemplo: Reação entre o cloreto de magnésio (MgCl2) e o gás flúor (F2)
MgCl2 + F2 →
Nesse caso, na substância composta, há a presença do elemento cloro e, na simples, o flúor. De acordo com a ordem de reatividade, o flúor é mais reativo que o cloro e, por isso, haverá o deslocamento:
MgCl2 + F2 → MgF2 + Cl2
Como resultado dessa reação, temos a formação de uma substância composta, em que o magnésio interage com o flúor, e de uma substância simples formada apenas pelo cloro.
É preciso ressaltar que, na montagem da substância composta do produto, levamos em consideração a carga (NOX) que o cátion apresenta e a carga do ametal quando estabelece uma ligação.
Forma-se, então, a molécula MgF2 porque o NOX do Mg é +2 (por ser da família dos metais alcalinoterrosos) e do F é -1 (por ser da família dos halogênios). Já a substância simples é formada por dois átomos do mesmo halogênio.
2º Exemplo: Reação entre o fluoreto de cobre II (CuF2) e o iodo sólido (I2)
CuF2 + I2 →
Nessa substância composta, há a presença do elemento flúor e, na simples, o elemento iodo. De acordo com a ordem de reatividade, o flúor é mais reativo que o iodo, por isso, não haverá deslocamento (a reação não ocorre).
CuF2 + I2 → não ocorre
3º Exemplo: Reação entre o brometo de sódio (NaBr) e o cloro gasoso (Cl2)
NaBr + Cl2 →
Na substância composta, há a presença do elemento bromo e, na simples, o elemento cloro. De acordo com a ordem de reatividade, o cloro é mais reativo que o bromo e, por essa razão, haverá o deslocamento:
2 NaBr + Cl2 → 2 NaCl + Br2
Como resultado dessa reação, há a formação de uma substância composta, em que o sódio interage com o cloro, e de uma substância simples formada apenas pelo bromo.
Nesse processo, é formada a molécula de NaCl porque o NOX do Na é +1 (por ser da família dos metais alcalinos) e o do Cl é -1 (por ser da família dos halogênios). Já a substância simples é formada por dois átomos de um mesmo halogênio.
Observação: Caso a substância simples seja formada com o enxofre, ela possuirá oito átomos.
Aproveite para conferir nossa videoaula sobre o assunto: