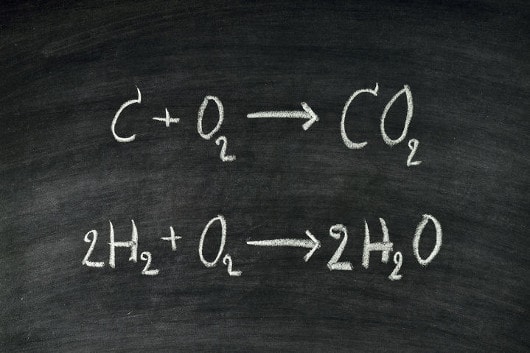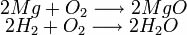Reações químicas são processos de interconversão de espécies químicas, ou seja, processos em que uma substância é convertida em outra. No cotidiano da Química, as reações são representadas por meio de equações químicas, as quais devem estar devidamente balanceadas e respeitando as leis ponderais. Uma reação química pode ocorrer por uma única etapa ou por meio de várias etapas.
Reações químicas apresentam diversos mecanismos, sendo os mais comuns os de síntese, decomposição, simples troca, dupla troca ou combustão. Para que uma reação química ocorra, além do choque entre as substâncias, há necessidade de uma orientação espacial adequada, além de energia. As reações químicas estão presentes em quase tudo que nos envolve neste momento, sendo de suma importância a sua compreensão.
Leia também: Como identificar uma transformação química?
Tópicos deste artigo
- 1 - Resumo sobre reações químicas
- 2 - Videoaula sobre reações químicas
- 3 - O que são reações químicas?
- 4 - Propriedades das reações químicas
- 5 - Tipos de reações químicas
- 6 - Como ocorre uma reação química?
- 7 - Lei das reações químicas
- 8 - Balanceamento de uma reação química
- 9 - Exercícios resolvidos sobre reações químicas
Resumo sobre reações químicas
- Reações químicas são processos de interconversão de espécies químicas, fazendo com que uma substância seja transformada em outra.
- As reações químicas podem ser representadas por meio de equações químicas.
- As reações químicas podem se desenvolver em uma única etapa (elementares) ou em mais de uma etapa (multietapas).
- Os principais mecanismos reacionais são os de adição, decomposição, simples troca, dupla troca e a combustão.
- Uma reação química ocorre por meio do contato entre as substâncias, necessitando também de energia e orientação espacial adequada.
- As reações químicas são balanceadas pelo método das tentativas ou pelo método redox.
- As reações químicas estão presentes em praticamente tudo que está à nossa volta.
Videoaula sobre reações químicas
O que são reações químicas?
Uma reação química é um processo que resulta na interconversão das espécies químicas. Ou seja, é um processo que transforma uma ou mais substâncias químicas em uma ou mais substâncias químicas diferentes, mediante reorganização dos átomos envolvidos.
Propriedades das reações químicas
Toda reação química é representada por meio de equações químicas, uma representação simbólica em que os reagentes são dispostos à esquerda e os produtos, à direita. Tais espécies são separadas por uma seta (→), a qual indica o sentido da reação química. Caso a reação química seja reversível, ou seja, caso se desenvolva em dois sentidos, utiliza-se uma seta dupla (⇌). De modo geral:
Reagentes → Produtos
A proporção mínima, em mols, que cada substância possui na reação, conhecida como proporção estequiométrica, é indicada antes de cada substância, por meio de números. Também é possível indicar, após cada substância, o estado em que ela se encontra, sendo usado (s) para sólido, (l) para líquido, (g) para gasoso, (aq) para aquoso. Um exemplo é:
2 H2 (g) + O2 (g) → 2 H2O (l)
As reações químicas podem se desenvolver em uma única etapa, sendo chamadas de elementares, ou em duas ou mais etapas, sendo chamadas de reações em etapas ou multietapas. Em reações que ocorrem em mais de uma única etapa é visível a formação de espécies intermediárias, ou seja, substâncias químicas que serão formadas ao longo do processo, mas que não estarão presentes ao fim do processo, visto que serão consumidas.
Um exemplo de reação elementar é a síntese da amônia por meio dos gases nitrogênio e hidrogênio:
N2 (g) + 3 H2 (g) → 2 NH3 (g)
Já uma reação multietapas é a que se desenvolve entre os gases NO2 e CO:
Etapa I: 2 NO2 (g) → NO (g) + NO3 (g)
Etapa II: NO3 (g) + CO (g) → NO2 (g) + CO2 (g)
Percebe-se, na reação anteriormente descrita, que o gás NO3 é um intermediário dessa reação.
Leia também: Diferenças entre coeficientes e índices em equações químicas
Tipos de reações químicas
Basicamente existem cinco tipos de reações químicas, também conhecidos como mecanismos de reações químicas. São eles:
- Reação de síntese (ou adição): tipo de reação química em que duas ou mais substâncias se somam em um único produto.
MgO + H2O → Mg(OH)2
- Reação de decomposição (ou análise): mecanismo reacional em que uma única substância química se decompõe em duas ou mais substâncias.
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- Reação de simples troca (ou deslocamento): nesse tipo de reação química, um elemento presente em uma substância composta é substituído por outro elemento em uma substância simples.
Fe + CuSO4 → FeSO4 + Cu
- Reação de dupla troca (ou permutação): reação em que os elementos em substâncias compostas permutam entre si, ou seja, a espécie eletropositiva (ou cátion) de uma substância X se liga à espécie eletronegativa (ou ânion) de uma outra substância Y. Já a espécie eletropositiva (ou cátion) da substância Y se liga à espécie eletronegativa (ou ânion) da substância X.
CaO + H2SO4 → CaSO4 + H2O
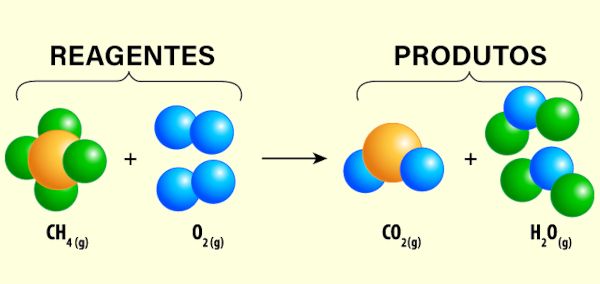
- Reação de combustão: modalidade de reação química em que um combustível (em geral, uma substância orgânica) é queimado na presença de um comburente (na maioria das vezes, gás oxigênio) com grande liberação de energia.
CH4 + 2 O2 → CO2 + 2 H2O
Como ocorre uma reação química?
A Teoria das Colisões é um modelo qualitativo simples e eficiente para explicar a ocorrência de uma reação química em nível molecular. Porém, antes de tudo, deve-se entender que é primordial que haja afinidade química entre as espécies envolvidas. Ou seja, não há como esperar que substâncias que não apresentem qualquer tipo de afinidade possam reagir e gerar produtos. É o exemplo dos óxidos neutros, como CO, NO e N2O, que não possuem afinidade química com a água e por isso não reagem com essa substância.
Segundo essa teoria, as moléculas ou demais participantes da reação química devem se chocar (colidir) para que haja a ocorrência da reação química. Porém, não é qualquer colisão envolvida entre as espécies que irá desencadear em uma reação química de fato. Por exemplo, assumindo-se que os átomos e moléculas participantes são bolas de bilhar, caso elas colidam com uma baixa velocidade, elas simplesmente irão ricochetear. Contudo, havendo velocidade (energia) suficiente, essas bolas podem se despedaçar.
Embora simplista, a ideia por trás dessa explicação está no fato de que átomos em uma molécula ou um composto iônico estão ligados por meio de ligações químicas, as quais possuem uma energia mínima necessária para se quebrarem. Assim sendo, caso a colisão seja de baixa velocidade, as substâncias irão simplesmente ricochetear, sem qualquer alteração em sua composição. Agora, caso se atinja pelo menos a energia necessária para quebrar essas ligações, os átomos presentes nas moléculas (ou compostos iônicos) irão se separar, ficando livres para o estabelecimento de novas ligações e havendo, dessa forma, a formação de novas substâncias.
Por isso, é possível dizer que as reações químicas exigem uma energia mínima para sua ocorrência, ou seja, um gatilho energético. Assim, a mínima energia necessária para desencadear um processo químico, ou seja, a mínima energia necessária para o rompimento das ligações químicas, é conhecida como energia de ativação.
Além do aspecto energético, outro fator é essencial para o êxito da reação. Moléculas não são, na maioria das vezes, simétricas. Por isso, há de se considerar a orientação espacial adequada para a colisão. Sendo entidades tridimensionais, as colisões ocorrem com direcionamento aleatório, ou seja, podem ser laterais, frontais, diagonais. Deve-se entender que uma colisão só será efetiva se ocorrer na orientação correta.
Observe, na imagem a seguir, duas possibilidades de colisão entre moléculas de NO e O3 para a formação de NO2 e O2. Uma dessas colisões não é efetiva, visto que colide de uma forma incapaz de retirar um átomo de oxigênio do O3. Já a outra colisão se mostra efetiva, pois quando o nitrogênio colide com um oxigênio periférico, é possível retirá-lo da estrutura do O3.
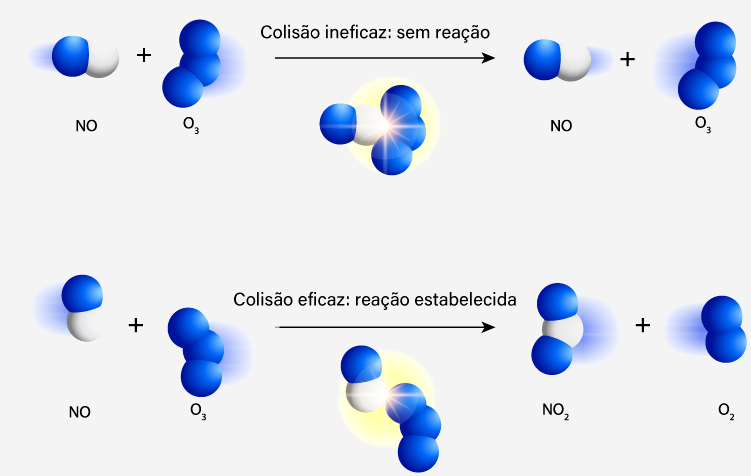
Em moléculas maiores isso se torna ainda mais complicado, pois, às vezes, apenas uma única parte é o sítio ativo e reacional. Isso, sem dúvida alguma, dificulta ainda mais o desenvolvimento da reação química.
Lei das reações químicas
As reações químicas são regidas por leis conhecidas como leis ponderais, ou lei das combinações químicas.
- Lei da conservação de massas: foi enunciada por Antoine Lavoisier em 1789 e afirma que, em sistemas fechados, a massa dos reagentes em uma reação química é sempre igual à massa dos produtos.
|
2 H2 (g) |
+ |
O2 (g) |
→ |
2 H2O (g) |
|
2 g |
|
16 g |
|
18 g |
- Lei das proporções definidas: foi enunciada por Joseph Proust em 1799 e afirma que uma substância química é sempre formada pelos mesmos elementos químicos, os quais sempre estarão combinados na mesma proporção de massa.
|
2 H2 (g) |
+ |
O2 (g) |
→ |
2 H2O (g) |
|
2 g |
|
16 g |
|
18 g |
|
4 g |
|
32 g |
|
36 g |
|
8 g |
|
64 g |
|
72 g |
- Lei das proporções múltiplas: foi enunciada por John Dalton em 1808 e afirma que, caso dois ou mais elementos químicos venham a formar substâncias compostas diferentes, a massa de um dos elementos irá variar em uma proporção de números inteiros, enquanto os demais permanecem fixos.
|
H2 (g) |
+ |
N2 (g) |
+ |
3 O2 (g) |
→ |
2 HNO3 (l) |
|
2 g |
|
28 g |
|
96 g |
|
126 g |
|
H2 (g) |
+ |
N2 (g) |
+ |
2 O2 (g) |
→ |
2 HNO2 (l) |
|
2 g |
|
28 g |
|
64 g |
|
94 g |
Balanceamento de uma reação química
Em conformidade com as leis ponderais, uma reação química deve ser devidamente balanceada, ou seja, não pode haver variação na quantidade total dos elementos, visto que há conservação da massa.
-
Método das tentativas
Para fazer o balanço em termos de massa é necessário alterar os coeficientes estequiométricos (números que ficam na frente das substâncias na equação química) adequadamente. Uma das formas é utilizando o chamado “método das tentativas”, cujo nome já deixa claro o que deve ser feito: acertar os valores dos coeficientes por tentativas até o êxito.
Contudo, entende-se que, em alguns casos, possa vir a ser exaustivo tentar acertar os coeficientes por meio de tentativas sucessivas. Para tal, algumas técnicas foram desenvolvidas. A mais difundida, sem dúvida alguma, é conhecida como regra do MACHO, um acrônimo para designar a ordem de preferência de balanço dos elementos: primeiro os metais, posteriormente os ametais, seguidos por carbono, depois hidrogênio e, por fim, o oxigênio. Vejamos um exemplo.
CaCO3 + H3PO4 → Ca3(PO4)2 + H2CO3
O primeiro elemento a ser balanceado é o metal alcalinoterroso cálcio. Enquanto nos reagentes há apenas uma unidade de Ca, nos produtos há 3 unidades. Por isso, deve-se colocar o coeficiente estequiométrico 3 para o CaCO3, igualando a quantidade de cálcio.
3 CaCO3 + H3PO4 → Ca3(PO4)2 + H2CO3
Seguindo, temos o ametal, que no caso é o fósforo (P). Percebe-se que o número de átomos de fósforo após a seta é igual a 2, no fosfato de cálcio. Assim, coloca-se o coeficiente 2 na frente do H3PO4 para igualar as quantidades.
3 CaCO3 + 2 H3PO4 → Ca3(PO4)2 + H2CO3
Seguindo a regra do MACHO, é o momento de acertar as quantidades de carbono (C). O coeficiente 3 colocado na frente do CaCO3 triplicou não só as quantidades de cálcio, mas também dos demais elementos, carbono e oxigênio. Assim, contabilizam-se 3 unidades de carbono nos reagentes. Para equidade, entende-se que o H2CO3 também deve ser multiplicado por 3.
3 CaCO3 + 2 H3PO4 → Ca3(PO4)2 + 3 H2CO3
Ao se chegar ao elemento hidrogênio é possível visualizar que as unidades desse elemento acabaram sendo acertadas enquanto foram realizados os balanços dos elementos anteriores (Ca, P e C). Percebe-se que há 6 unidades de hidrogênio antes e após a seta (o coeficiente estequiométrico é multiplicado pela atomicidade, número subscrito nas fórmulas químicas). O mesmo acontece para o átomo de oxigênio, tendo 17 unidades antes da seta (9 do CaCO3 e mais 8 do H3PO4) e depois dela (8 unidades no Ca3(PO4)2 e mais 9 unidades no H2CO3). Assim, é possível dizer que a reação está devidamente balanceada.
-
Método redox (oxidorredução)
Outra forma de balancear uma equação química se dá pelo princípio da eletroneutralidade, ou seja, a ideia de que a carga total dos reagentes deve ser igual à dos produtos.
Observe a seguinte reação:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Para iniciar, devemos determinar o número de oxidação de todos os elementos participantes, assim:
KMnO4: K = +1; Mn = +7; O = −2
HCl: H = +1; Cl = −1
KCl: K = +1; Cl = −1
MnCl2: Mn = +2; Cl = −1
Cl2: Cl = 0
H2O: H = +1; O = −1
Depois, devemos perceber quais espécies tiveram seus números de oxidação alterados quando foram transformados de reagentes para produtos. No caso, percebe-se que o manganês (Mn) passou de +7 para +2 (sofreu uma redução), enquanto o cloro passou de −1 para 0 (sofreu uma oxidação).
Porém, aqui há uma particularidade: o cloro participante do processo redox possui atomicidade diferente (está como HCl no reagente e Cl2 no produto), e, por isso, devemos igualar as quantidades de cloro previamente colocado um índice 2 no HCl. Assim:
KMnO4 + 2 HCl → KCl + MnCl2 + Cl2 + H2O
Pensando na eletroneutralidade, devemos entender que o número de elétrons usados para fazer oxidação é exatamente igual ao número de elétrons usados para se fazer a redução. Por isso, devemos fazer um pequeno MMC para igualar a quantidade de elétrons usados no processo redox.
Mn7+ --------- Mn2+ (perdeu 5 elétrons)
2 Cl− ------------ Cl2 (ganhou 2 elétrons cada cloro)
Para o completo balanço de cargas, multiplicamos as espécies envolvidas de manganês por 2 e as espécies envolvidas de cloro por 5, assim igualando o número de elétrons (10).
2 KMnO4 + 10 HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Os demais índices são acertados pelo método das tentativas. Note que o HCl teve que ser reajustado após avaliação pelo método das tentativas.
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
Veja também: Mais exemplos de balanceamento de equações químicas
Exercícios resolvidos sobre reações químicas
Questão 1
(Unitins/2023-1) A lei de conservação da massa ou lei de Lavoisier demonstra que, nas reações de combustão, as massas de todas as substâncias envolvidas permanecem inalteradas. A massa pesada no início, antes da reação, é a mesma do final desde que a reação seja feita em um recipiente fechado.
Analise a representação abaixo e considere que a reação ocorre em sistema fechado.
|
PAPEL |
+ |
OXIGÊNIO |
→ |
GASES |
+ |
CINZAS |
|
10 g |
|
x |
|
2 g |
|
9 g |
A quantidade de oxigênio é
(A) 11 g
(B) 7 g
(C) 1 g
(D) 21 g
(E) 0 g
Resposta: Letra C
Segundo a lei da conservação de massa:
10 + x = 2 + 9
10 + x = 11
x = 11 – 10
x = 1 g
Questão 2
(Unemat/2022-2) Um estudante de Química tentou verificar em laboratório a lei de conservação da massa, proposta por Antoine Lavoisier. Ele acompanhou duas reações em um recipiente de vidro aberto sobre uma balança analítica, medindo, dessa forma, a massa dos reagentes de partida e a massa dos produtos formados. A primeira reação foi a queima do magnésio metálico em ar, formando um sólido esbranquiçado e, para sua surpresa, a massa do sistema final foi maior que a do sistema inicial. Por outro lado, no segundo teste reacional, ao aquecer uma amostra de açúcar até transformá-lo em caramelo, observou a diminuição da massa final em relação à inicial.
PERUZZO, F. M.; CANTO, E. L. Química na abordagem do cotidiano, v. 1. 4 ed. Moderna: São Paulo, 2006.
Qual foi o erro cometido pelo estudante (se houver) e por que ele não observou a conservação da massa dos reagentes e produtos em sua experimentação?
(A) Em um sistema aberto, não é possível observar a lei de conservação da massa, uma vez que as correntes de ar podem interferir na pesagem dos materiais.
(B) As reações de queima não seguem a lei de Lavoisier, porque envolvem o oxigênio molecular (O2) como reagente, que, por ser gasoso, é de difícil pesagem.
(C) Os experimentos deveriam ter sido realizados em sistemas fechados. No primeiro estudo houve ganho de massa da vizinhança, e no segundo houve perda de massa para a vizinhança.
(D) O estudante não cometeu nenhum engano e deveria ter observado massa constante nos dois experimentos, conforme o esperado. Provavelmente, o erro analítico foi devido a algum defeito na balança analítica utilizada.
(E) As reações escolhidas não seguem a lei de Lavoisier, pois na primeira ocorre a criação de nova matéria e na segunda há a destruição do material de partida.
Resposta: Letra C.
A lei de Lavoisier só é observável em sistemas fechados. O magnésio (Mg) foi convertido em óxido de magnésio (MgO), acrescentando-se, assim, a massa de oxigênio:
2 Mg (s) + O2 (g) → 2 MgO (s)
Já na segunda reação, a queima de açúcar produziu gás carbônico (CO2), que, por ser um gás, expandiu-se e se difundiu, abandonando o sistema reacional e assim fazendo a massa cair.
Fontes
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
USBERCO, J.; SALVADOR, E. Química. 9ª. ed. São Paulo: Saraiva, 2013.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. GoldBook – Compendium of Chemical Terminology. Disponível em: < https://goldbook.iupac.org/>.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 4. ed. Harlow (Inglaterra): Pearson Education Limited, 2012.
LEAL, M. C. Como a Química Funciona? Química Nova na Escola. n. 14, nov. 2001.