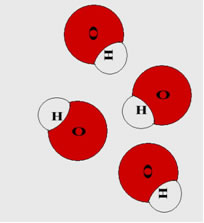
O ácido libera o cátion hidrogênio (H+) e a base fornece o ânion hidroxila ou hidróxido (OH-), que dão origem à molécula de água.
Existem dois tipos de reações de neutralização: neutralização total e neutralização parcial. Vejamos cada uma delas:
• Neutralização Total:
Ocorre quando todo o ácido e toda a base são convertidos em sal e água. Isso ocorre quando a quantidade de cátion H+ e ânions OH- é igual. Tanto a base quanto o ácido são fortes. Isso significa que a neutralização total ocorre quando todos os átomos de hidrogênio ionizáveis provenientes do ácido são neutralizados por todos os ânions hidróxido provenientes da base, produzindo água e sal. Conforme mostrado abaixo:
1 H+ + 1 OH- → 1 H2O
Exemplos de reações de neutralização total:

• Neutralização Parcial:
Ocorre quando possui mais ácido ou mais base, assim o que estiver em excesso não é neutralizado totalmente. Nem todos os hidrogênios ionizáveis do ácido ou nem todas as hidroxilas da base são neutralizadas.
Exemplo de neutralização parcial da base (base forte e ácido fraco):
HCl + Mg(OH)2 → Mg(OH)Cl + H2O
Note que o ácido (HCl) libera um cátion (H+), porém a base (Mg(OH)2) dá origem a dois ânions (OH-). Em razão dessa desproporção, a base, que está em excesso, não será neutralizada totalmente. O sal formado não é neutro, mas sim um sal básico. Esse sal também é chamado de hidróxi-sal.
Um exemplo de sal básico é o bicarbonato de sódio (NaHCO3(S)), que é muito usado como princípio ativo de efervescentes antiácidos (que combatem a acidez estomacal), além de ser usado também como fermento de pães e bolos e até mesmo em extintores de incêndio.
Exemplo de neutralização parcial do ácido (ácido forte e base fraca):
H3PO4 + NaOH → NaH2PO4 + H2O
Nesse caso, enquanto o ácido fornece íons H+, a base fornece apenas 1 íon OH-. Assim, o ácido não é neutralizado completamente, originando um sal ácido ou hidrogeno-sal.
Aproveite para conferir nossa videoaula sobre o assunto: