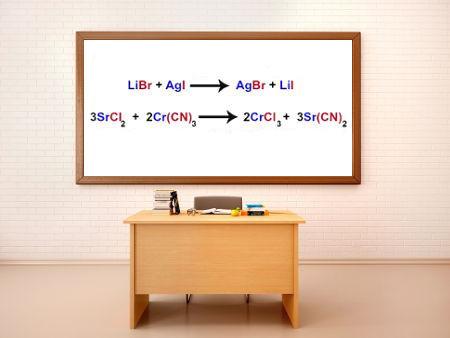
As reações de dupla troca entre sais são reações químicas nas quais os reagentes são dois sais (não possuem hidrônio - H+ nem hidroxila - OH-) que, ao interagirem, dão origem a dois novos sais no produto. Abaixo temos uma equação que representa uma dupla troca entre dois sais (NaCl e KBr):
NaCl + KBr → NaBr + KCl
a) Características das reações de dupla troca entre sais
Trata-se de uma reação de dupla troca porque ocorrem duas trocas entre os sais. Assim, o cátion de um sal interage com o ânion do outro sal.
-
Sal NaCl: Na é o cátion e o Cl é o ânion
-
Sal KBr: K é o cátion e o Br é o ânion
A dupla troca entre os sais NaCl e KBr acontece quando o cátion Na interage com o ânion Br, e o cátion K interage com o ânion Cl, formando os sais NaBr e KCl.
É importante ressaltar que, sempre que formos equacionar uma reação de dupla troca entre sais, devemos levar em consideração a carga de cada cátion e ânion que formam os sais. Isso é necessário porque a montagem da fórmula do novo sal envolve o cruzamento das cargas do cátion e ânion envolvidos.

Cruzamento das cargas do cátion e ânion que formam o sal
Após o cruzamento das cargas, a carga do cátion transforma-se no índice (número escrito à direita da sigla do elemento) do ânion e vice-versa.
b) Macetes para reações de dupla troca entre sais
Conheça agora os macetes que nos ajudam a determinar a carga dos cátions e ânions dos sais dos reagentes das reações.
Macete 1: Sais com parênteses na fórmula:
Quando os sais possuem parênteses, estes sempre estão delimitando o cátion (se no primeiro grupo da fórmula) ou o ânion (se no segundo grupo da fórmula). O índice logo após os parênteses pertence ao outro grupo, isto é, o índice na frente dos parênteses com o cátion, por exemplo, será a carga do ânion e vice-versa. Veja alguns exemplos:
Exemplo 1: Al2(SO4)3
-
Al é o cátion cuja carga é +3 porque 3 é o número logo após o ânion;
-
SO4 é o ânion cuja carga é -2 porque 2 é o número logo após o cátion.
OBS.: Sempre que o ânion apresentar um índice na frente do elemento oxigênio, trata-se de um número que faz parte da constituição do grupo que forma o ânion, ou seja, não é carga de ninguém.
Exemplo 2: (NH4)2S
-
NH4 é o cátion cuja carga é +1 porque 1 é o número logo após o ânion;
-
S é o ânion cuja carga é -2 porque 2 é o número logo após o cátion.
Macete 2: Sais sem parênteses e sem índices nas fórmulas
Sempre que os sais não apresentarem parênteses ou índice, para determinar as cargas dos cátions, basta conhecer a carga dos ânions, pois, nesses casos, a carga do cátions sempre terá o mesmo valor da carga do ânion, mas com sinal positivo.
Para isso, é interessante ter conhecimento sobre a tabela dos principais ânions:

Tabela com os ânions mais comuns em sais inorgânicos
Agora, veja os exemplos:
Exemplo 1: NaNO3
-
NO3 é o ânion e, segundo a tabela, apresenta carga -1, logo:
-
Na é o cátion e terá carga +1.
Exemplo 2: CaS
-
S é o ânion e, segundo a tabela, apresenta carga -2, logo:
-
Ca é o cátion e terá carga +2.
Macete 3: Para reagente com índice no cátion ou no ânion
Sempre que o sal tiver índice em um dos seus componentes, esse índice será a carga do componente oposto, ou seja, índice no cátion é a carga do ânion e vice-versa. Veja os exemplos:
Exemplo 1: CaCl2
-
Ca é o cátion cuja carga pe +2 porque 2 é o número logo após o ânion;
-
Cl é o ânion cuja carga é -1 porque 1 é o número logo após o cátion.
Exemplo 2: Au2CO3
-
Au é o cátion cuja carga é +1 porque 1 é o número logo após o ânion;
-
CO3 é o ânion cuja carga é -2 porque 2 é o número logo após o cátion.
c) Exemplos de construção de equações de reações de dupla troca:
Agora vamos acompanhar a montagem de algumas reações de dupla troca entre sais
1ª Reação: Dupla troca entre Sulfato de Alumínio e Sulfeto de amônio
Al2(SO4)3 + (NH4)2S →
Para montar os produtos da reação de dupla troca dos sais, utilizaremos:
-
Cruzamento de cargas entre o cátion NH4+1 e o ânion SO4-2
-
Cruzamento de cargas entre o cátion Al+3 e o ânion S-2:
Assim, a equação terá os seguintes componentes:
Al2(SO4)3 + (NH4)2S → (NH4)2SO4+ Al2S3
OBS.: Nunca se esqueça de balancear a equação, se for necessário:
1 Al2(SO4)3 + 3 (NH4)2S → 3 (NH4)2SO4 + 1 Al2S3
Para balancear essa equação, colocamos o 3 no (NH4)2S do reagente para igualar com a quantidade de S no produto e posicionamos o coeficiente 3 no (NH4)2SO4 do produto para igualar com a quantidade de SO4 do reagente.
2ª Reação: Dupla troca entre Nitrato de sódio e Sulfeto de Cálcio
NaNO3 + CaS →
Para montar os produtos dessa reação de dupla troca, utilizaremos:
-
Cruzamento de cargas entre o cátion Na+1 e o ânion S-2
-
Cruzamento de cargas entre o cátion Ca+2 e o ânion NO3-1
Assim, a equação terá os seguintes componentes:
NaNO3 + CaS → Ca(NO3)2 + Na2S
OBS.: Nunca se esqueça de balancear a equação, se for necessário:
2 NaNO3 + 1 CaS → 1 Ca(NO3)2 + 1 Na2S
Para balancear essa equação, colocamos o coeficiente 2 no NaNO3 do reagente para igualar com a quantidade de NO3 e Na nos produtos.
3ª Reação: Dupla troca entre Cloreto de Cálcio e Carbonato de Ouro I
CaCl2 + Au2CO3 →
Para montar os produtos dessa reação de dupla troca, utilizaremos:
-
Cruzamento de cargas entre o cátion Ca+2 e o ânion CO3-2:
-
Cruzamento de cargas entre o cátion Au+1 e o ânion Cl-1:
Assim, a equação terá os seguintes componentes:
1 CaCl2 + 1 Au2CO3 → 1 CaCO3 + AuCl
OBS.: Nunca se esqueça de balancear a equação, se for necessário:
Para balancear essa equação, colocamos o coeficiente 2 no AuCl do produto para igualar com a quantidade de Cl e Au nos reagentes.
Videoaulas relacionadas: