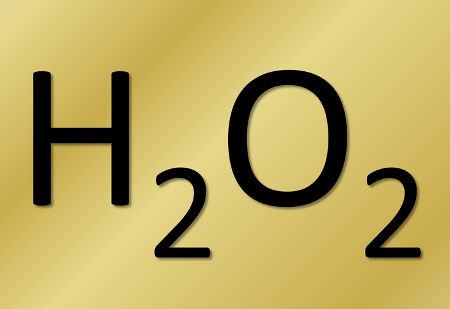Reações com peróxidos são fenômenos químicos nos quais os peróxidos inorgânicos participam como reagentes ao lado de outros reagentes como a água ou um ácido inorgânico.
Obs.: Peróxidos são substâncias binárias em que o oxigênio é o elemento mais eletronegativo e apresenta nox -1, ao lado de hidrogênio ou elementos metálicos, como os metais prata (Ag), zinco (Zn), alcalinos (IA) ou alcalinoterrosos (IIA).
Em todas as reações com peróxidos, um dos produtos formados é sempre o mesmo, que é o peróxido de hidrogênio (H2O2), e o outro produto, que pode ser um ácido ou a água, depende do tipo de reagente – uma base ou um sal inorgânico – que interagiu com o peróxido.
Reações dos peróxidos com água
Quando um peróxido metálico, ou seja, aquele que apresenta um metal em sua composição, reage com água, sempre ocorre a formação de uma base inorgânica e do peróxido de hidrogênio, como podemos observar na equação geral abaixo:
YO2(s) + H2O → YOH(s) + H2O2(L)
A base formada nessa reação apresenta o cátion do peróxido e o ânion hidróxido (OH-) da água. Lembrando ainda que o peróxido de hidrogênio é uma substância instável, a qual sofre decomposição, isto é, transforma-se em gás oxigênio e água, desde que não esteja na presença de um ácido.
H2O2(L) → O2(g) + H2O(L)
Por isso, a forma correta de escrever uma equação da reação de um peróxido com água é:
YO2(s) + H2O → YOH(s) O2(g) + H2O(L)
Reações dos peróxidos com ácidos inorgânicos
Quando um peróxido metálico reage com um ácido inorgânico, sempre ocorre a formação de um sal inorgânico e do peróxido de hidrogênio, como podemos observar na seguinte equação geral:
YO2(s) + HX → YX(s) + H2O2(L)
Obs.: Como o peróxido formado está em um meio ácido, não sofrerá a decomposição.
O sal formado nessa reação apresenta o cátion (Y+) do peróxido e o ânion (X-) do ácido.
Exemplos de reações com peróxidos
1º Exemplo: Reação do peróxido de cálcio (CaO2) com o ácido fosfórico (H3PO4).
Como se trata da reação entre um peróxido e um ácido, teremos a formação de um sal e do peróxido de hidrogênio, que, como já mencionado, não se decompõe por estar em meio ácido.
CaO2(s) + H3PO4 → YX(s) + H2O2(L)
O sal fosfato de cálcio [Ca3(PO4)2] será formado pela interação do cátion cálcio (Ca+2) do peróxido com o ânion fosfato (PO4-3). A seguir, temos a equação balanceada dessa reação com peróxido:
3 CaO2(s) + 2 H3PO4 → 1 Ca3(PO4)2(s) + 3 H2O2(L)
2º Exemplo: Reação do peróxido de prata (Ag2O2) com a água (H2O2).
Como se trata da reação entre um peróxido e água (H2O), haverá a formação de uma base e do peróxido de hidrogênio.
Ag2O2 + H2O → YX(s) + H2O2(L)
A base hidróxido de prata [AgOH] será formada pela interação do cátion cálcio (Ag+1) do peróxido com o ânion hidróxido da água (OH-1). Observe a equação balanceada dessa reação com peróxido:
1 Ag2O2 + 4 H2O → 2 AgOH + 1 H2O(L) + 3/2 O2(L)