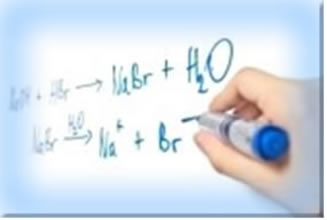Uma reação com óxidos básicos ocorre quando essa classe específica de óxido (as outras são os óxidos ácidos, neutros, anfóteros e mistos) é colocada em um mesmo recipiente com uma das substâncias abaixo:
-
Água;
Nessas reações, são produzidas diferentes substâncias, como:
-
Água;
-
Sal orgânico.
O produto formado nesse tipo de reação sempre dependerá do tipo de reagente utilizado para reagir com o óxido básico, como podemos ver a seguir.
Reações com óxidos básicos e água
Quando um óxido básico reage com água, sempre há a formação de uma base inorgânica, que contém o cátion formado pelo metal do óxido e o ânion hidróxido (OH).
1º Exemplo: óxido de estrôncio (SrO) e água
A reação entre o óxido de estrôncio e água forma a base hidróxido de estrôncio, resultante da interação entre o cátion estrôncio (Sr+2) do óxido, por pertencer à família IIA, e o ânion hidróxido (OH-1). Observe a seguinte equação balanceada desse processo:
SrO + H2O → Sr(OH)2
2º Exemplo: óxido de cobre I (Cu2O) e água
A reação entre o óxido de cobre I e água forma a base hidróxido de cobre I, resultante da interação entre o cátion cobre I (Cu+1) do óxido e o ânion hidróxido (OH-1). Veja a equação balanceada desse processo:
Cu2O + H2O → 2 CuOH
Reações dos óxidos básicos com ácidos
Sempre que um óxido básico reage com um ácido inorgânico (ou orgânico), ocorre a formação de um sal e de água. O sal é formado pelo cátion (referente ao metal) do óxido e pelo ânion do ácido, e a água é formada pela interação entre o hidrogênio do ácido e o oxigênio do óxido.
1º Exemplo: óxido de lítio (Li2O) e ácido bromídrico (HBr)
No óxido de lítio, há o cátion lítio (Li+1), por pertencer à família IA, e, no ácido, há o ânion brometo (Br-1). Assim, o sal formado será o brometo de lítio (LiBr). Observe a equação balanceada desse processo:
Li2O + 2 HBr → 2 LiBr + H2O
2º Exemplo: óxido de cálcio (CaO) e ácido carbônico (H2CO3)
No óxido de cálcio, há o cátion cálcio (Ca+2), por pertencer à família IIA, e, no ácido, temos o ânion carbonato (CO3-2). Assim, o sal formado será o carbonato de cálcio (CaCO3). Veja a seguir a equação balanceada desse processo:
CaO + H2CO3 → CaCO3 + H2O
Reações dos óxidos básicos com óxidos ácidos
Sempre que um óxido básico reage com um óxido ácido, forma-se apenas um sal inorgânico. O sal é formado pelo cátion (referente ao metal) do óxido básico e pelo ânion formado na associação do óxido ácido com o oxigênio do óxido básico.
1º Exemplo: óxido de sódio (Na2O) e dióxido de carbono (CO2)
No óxido de sódio, temos o cátion sódio (Na+1), por pertencer à família IA, e o óxido ácido que, ao interagir com o oxigênio do óxido básico, forma o ânion carbonato (CO3-2). Assim, o sal formado será o carbonato de sódio (Na2CO3). Observe a equação balanceada desse processo:
Na2O + CO2 → Na2CO3
2º Exemplo: óxido de bário (BaO) e trióxido de enxofre (SO3)
No óxido de bário, há o cátion bário (Ba+2), por pertencer à família IIA. O óxido ácido, ao interagir com o oxigênio do óxido básico, forma o ânion sulfato (SO4-2). Assim, o sal formado será o sulfato de bário (BaSO4). Veja a equação balanceada desse processo:
BaO + SO3 → BaSO4
Reações dos óxidos básicos com óxidos anfóteros
Sempre que um óxido básico reage com um óxido anfótero, temos a formação de sal inorgânico. O sal será formado pelo cátion (referente ao metal) do óxido básico e pelo ânion originado do metal contido no óxido básico.
A tabela a seguir apresenta os ânions formados pelos metais dos óxidos anfóteros:
.jpg)
Tabela contendo ânions formados por metais
1º Exemplo: óxido de rubídio (Rb2O) e óxido de crômio III (Cr2O3)
No óxido de rubídio, há o cátion rubídio (Rb+1), por pertencer à família IA, e, no óxido de crômio III, há o cátion crômio, que forma o ânion cromito (CrO2-1). Assim, o sal formado será o cromito de rubídio (RbCrO2). Observe a equação balanceada desse processo:
Rb2O + Cr2O3 → 2 RbCrO2
2º Exemplo: óxido de magnésio (MgO) e óxido de chumbo IV (PbO2)
No óxido de magnésio, temos o cátion magnésio (Mg+2), por pertencer à família IIA, e, no óxido de chumbo IV, temos o cátion chumbo IV, que forma o ânion plumbato (PbO3-2). Assim, o sal formado será o plumbato de magnésio (MgPbO3). Observe a equação balanceada desse processo:
MgO + PbO2 → MgPbO3