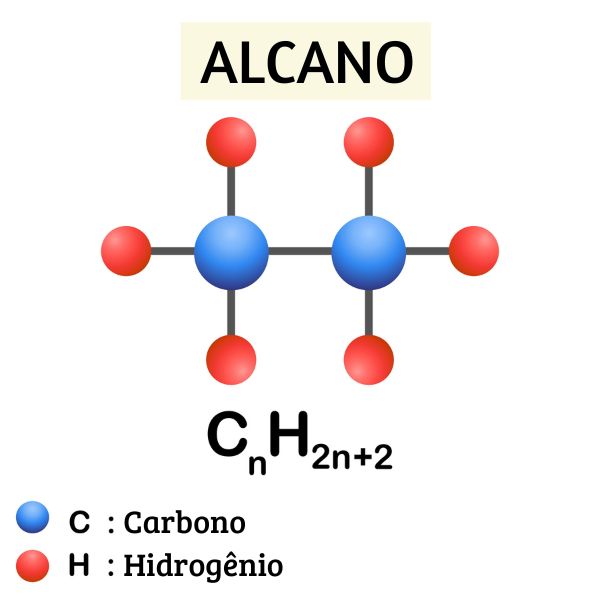
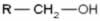A reação de redução de álcoois, reação de Berthelot ou método de Berthelot origina um hidrocarboneto da classe dos alcanos, um haleto orgânico, água e iodo sólido.
Como toda reação de redução, ela depende de uma oxidação. Assim, nesse processo químico, temos uma espécie química que sofre oxidação e outra que sofre redução. Essa reação foi descoberta pelo químico francês Berthelot no ano de 1905.
→ Materiais necessários para a redução de álcoois
a) Um álcool
Álcool é toda substância química que apresenta o grupo hidroxila ligado diretamente a um átomo de carbono saturado.
.jpg)
Estrutura geral de um álcool
Os grupos R representados acima podem ser tanto átomos de hidrogênio quanto radicais orgânicos.

Fórmula estrutural de um álcool qualquer
Uma reação de redução de Berthelot ocorre sempre na presença de um álcool, não importando o tamanho nem a sua classificação (álcool primário, secundário e terciário).
b) Ácido iodídrico concentrado
Esse ácido é um composto molecular cuja fórmula molecular é HI e apresenta uma ligação simples entre os átomos de carbono e iodo.
c) Fonte de calor (chapa de aquecimento elétrica de laboratório)
A chapa de aquecimento é utilizada para aumentar a velocidade em que as moléculas movimentam-se no interior do recipiente, favorecendo, assim, uma maior interaçãoentre elas.
→ Produtos formados a partir da redução de álcoois
A reação de redução dos alcoóis pode ser representada em duas etapas:
1a Etapa: Formação de haleto orgânico e água
Nessa etapa, o álcool interage com o ácido iodídrico e produz um haleto orgânico e uma molécula de água (H2O):

Equação de formação do haleto orgânico e água na redução do álcool
-
2a Etapa: Formação de alcano e iodo sólido
Nessa etapa, o haleto orgânico formado na primeira etapa reage com o ácido iodídrico presente na reação e forma um alcano e iodo sólido.

Equação de formação do alcano e do iodo sólido na redução do álcool
→ Mecanismos da reação de redução de álcoois
Durante uma reação de redução de alcoóis, vários acontecimentos são fundamentais para que cada um dos produtos seja formado. Esses acontecimentos são denominados quimicamente de mecanismos. São eles:
a) Cisões (quebras) de ligações
-
Quebra da ligação simples entre o carbono e a hidroxila (OH)
O grupo hidroxila apresenta uma forte atração pela ligação simples com o carbono, já que o oxigênio é um elemento químico muito eletronegativo (capaz de atrair para si os elétrons de uma ligação). Assim, a ligação simples está sempre mais próxima do grupo hidroxila.
Como as moléculas chocam-se com muita intensidade em virtude do calor, logo ocorre a quebra da ligação simples entre o carbono e a hidroxila. Com isso, o carbono fica deficiente em elétrons, e o grupo hidroxila fica com mais elétrons:

Quebra da ligação simples entre carbono e hidroxila
-
Quebra da ligação simples entre o hidrogênio e o cloro
O grupo iodo apresenta uma forte atração pela ligação simples com o hidrogênio, já que é um elemento químico mais eletronegativo Assim, a ligação simples está sempre mais próxima do iodo.
Como as moléculas chocam-se com muita intensidade, logo ocorre a quebra da ligação simples entre o hidrogênio e iodo. Assim, o hidrogênio fica deficiente em elétrons, e o iodo apresenta-se com mais elétrons:

Quebra da ligação simples entre iodo e hidrogênio
-
Quebra da ligação entre iodo e carbono
O grupo iodo apresenta uma forte atração pela ligação simples com o carbono do haleto orgânico, já que é um elemento químico mais eletronegativo. Assim, a ligação simples está sempre mais próxima do iodo.
Como as moléculas chocam-se com muita intensidade, logo ocorre a quebra da ligação simples entre o carbono e o iodo. Assim, o carbono fica deficiente em elétrons, e o iodo fica com mais elétrons:

Quebra da ligação simples entre iodo e o carbono no haleto
b) Interação entre os íons presentes na reação
Após as cisões de ligações, há o surgimento de íons negativos (OH- e I-) e íons positivos (H+ e o C+, carbono que perdeu a hidroxila). Na reação de Berthelot, as condições em que ela ocorre favorecem a interação entre os seguintes íons:
-
Interação entre o OH- e o H+ e formação da água (H2O)

Interação entre o cátion H+ e o ânion OH-
-
Interação entre os ânions I- e formação do iodo sólido (I2)

Interação entre os íons iodo
-
Interação entre I- e o C+ e formação de haleto orgânico

Interação entre o ânion I- e o cátion C+
-
Interação entre C+ e H+ e formação de alcano

Interação entre os cátions H+ e C+
OBS.: Como existe uma quantidade grande de ácido iodídrico no meio, a formação do haleto orgânico ocorre apenas de forma temporária, pois ele é logo transformado em um alcano.
→ Exemplos de equações de redução de álcoois
-
Reação de redução do propan-2-ol

Fórmula estrutural do propan-2-ol
Quando o propan-2-ol (um álcool secundário) é colocado em um meio com ácido iodídrico e passa por aquecimento, 2-iodo-propano e água são formados.

Equação de formação do 2-iodo-propano e água
Porém, como a quantidade de ácido iodídrico no meio é muito alta, o haleto formado reage com ele e forma o propano e iodo sólido.

Equação de formação do propano e iodo sólido
-
Reação de redução do 3-metil-pentan-3-ol

Fórmula estrutural do 3-metil-pentan-3-ol
Quando o 3-metil-pentan-3-ol (um álcool terciário) é colocado em um meio com ácido iodídrico e passa por aquecimento, 3-iodo-3-metil-pentano e água são formados.

Equação de formação do 3-iodo-3-metil-pentano e água
Porém, como a quantidade de ácido iodídrico no meio é muito alta, o haleto formado reage com ele e forma o propano e iodo sólido.

Equação de formação do propano e iodo sólido