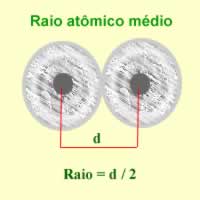
Não é possível determinar com precisão o raio atômico (distância do núcleo até a camada ou nível de energia mais externo) de um átomo isolado, porém é possível calcular qual é esse raio por meio da distância entre os núcleos de dois átomos de um mesmo elemento, sem estarem ligados e considerando o átomo como esferas.
Isso acontece quando se incide um feixe de raios X sobre uma amostra de um material sólido formado por átomos ou íons do mesmo elemento. Esses raios sofrem uma deflexão e são registrados em uma chapa fotográfica, na qual é possível visualizar a localização desses átomos, bem como a distância entre seus núcleos.
Essa distância entre os núcleos pode ser considerada como igual ao diâmetro de cada átomo, pois se trata de átomos iguais. Visto que a metade do diâmetro equivale ao mesmo que o raio, é só dividir esse valor para encontrar o raio atômico.
Por exemplo, a distância entre dois núcleos de átomos de ferro é igual a 2,48 Å (1 angtröm (Å) = 10-1 nm). Isso significa que o raio atômico do ferro é 1,24 Å.

Raio atômico é a metade do diâmetro atômico.
O raio atômico é uma propriedade periódica, isso significa que à medida que o número atômico aumenta, os raios atômicos dos elementos da tabela periódica assumem variações fixas, isto é, os tamanhos dos raios atômicos variam de forma periódica de acordo com a família e o período do elemento. Vejamos como isso se dá:
• Variação do raio atômico na mesma família:
A diferença de um elemento para o outro em uma mesma família na Tabela Periódica é que, de cima para baixo, o número de camadas eletrônicas aumenta. Com isso, o raio atômico também aumentará.
Desse modo, conclui-se que:

Variação do raio atômico na mesma família.
Observe como isso ocorre com os elementos da família 1 da Tabela Periódica:

Variação do tamanho do raio atômico na família 1 da tabela periódica.
• Variação do raio atômico no mesmo período:
Todos os elementos que pertencem ao mesmo período na Tabela Periódica possuem a mesma quantidade de camadas ou níveis de energia, portanto não são as camadas que irão alterar o tamanho do raio atômico.
A diferença de um para o outro é que o número atômico, isto é, a quantidade de prótons no núcleo vai aumentando da esquerda para a direita, ou seja, com o aumento das famílias, a atração dos elétrons pelo núcleo também aumenta. Consequentemente, o tamanho do raio atômico diminui.
Assim, conclui-se que:

Variação do raio atômico no mesmo período.
Abaixo temos o exemplo de como isso ocorre no segundo período da Tabela Periódica:

Variação do tamanho do raio atômico no segundo período da tabela periódica.
Portanto, podemos representar a variação do raio atômico na tabela periódica da seguinte forma:

Relação da variação do raio atômico na tabela periódica.
Videoaula relacionada: