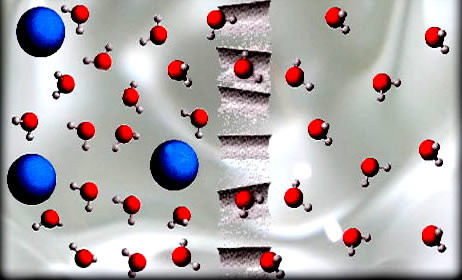
As propriedades das soluções que dependem do solvente e da concentração do soluto, e não da natureza deste, são denominadas propriedades coligativas.
Existem quatro propriedades coligativas mais importantes, que são:
- Tonoscopia ou Tonometria: abaixamento da pressão de vapor;
- Ebulioscopia ou Ebuliometria: elevação da temperatura de ebulição;
- Crioscopia ou Criometria: abaixamento da temperatura de fusão;
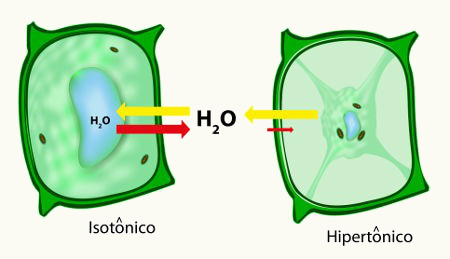
- Osmometria: variação da pressão de osmose.
Essas propriedades têm muitas aplicações no cotidiano. Pelo estudo delas, é possível responder as seguintes dúvidas abaixo:
- Por que a água filtrada congela quando é colocada no congelador da geladeira e água com sal não congela?
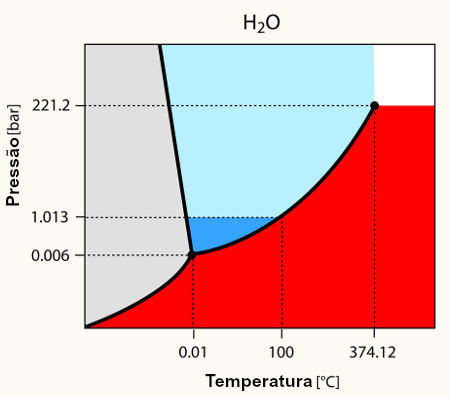
- Será que a água pode permanecer líquida acima de 100°C?
- Será que em uma garrafa fechada há água evaporada?
- Qual a diferença entre as bolhas formadas ao aquecermos água e as existentes no interior de um copo com refrigerante?
- Será que a temperatura de ebulição da água depende da pressão atmosférica?
- Por que se acrescenta sal no gelo utilizado para gelar cervejas em lata?
- Por que, acrescentando sal ou açúcar a uma quantidade de água que está iniciando fervura, ela para de ferver?
- Por que as águas dos oceanos não congelam, mesmo em locais muito frios, com a temperatura abaixo de 0°C?
- Por que um peixe de água doce não sobrevive no mar e vice-versa?
Descubra as respostas nos textos desta subseção.