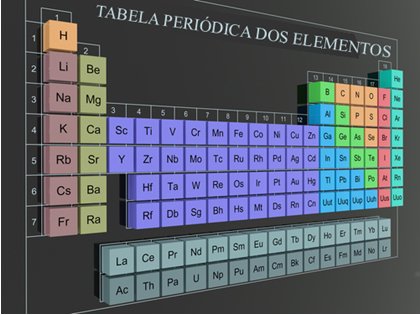
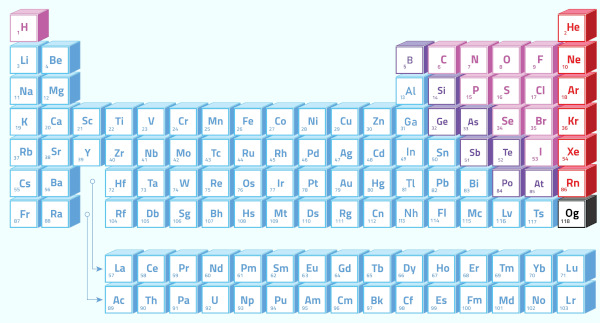
As propriedades dos elementos químicos estão diretamente ligadas à posição que os mesmos ocupam na tabela periódica, prova disso é a existência das chamadas Propriedades periódicas. À medida que o número atômico aumenta, os elementos assumem valores crescentes ou decrescentes em cada período. Veja a seguir algumas das principais propriedades periódicas:
Densidade
Nas famílias (colunas verticais da tabela), a densidade dos elementos aumenta juntamente com as massas atômicas: de cima para baixo. Já nos períodos (linhas horizontais da tabela), a densidade aumenta das extremidades para o centro.

A tabela cima ajuda a entender esta propriedade. A ilustração permite localizar o elemento mais denso de todos: o ósmio (Os) → densidade = 22,5 g/cm3 , localizado na parte central e inferior da tabela.
Raio atômico
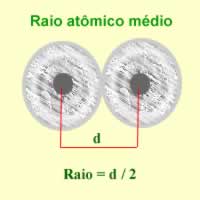
Essa propriedade se relaciona com o tamanho do átomo, e para comparar esta medida é preciso levar em conta dois fatores:
- Quanto maior o número de níveis, maior será o tamanho do átomo;
- O átomo que apresenta maior número de prótons exerce uma maior atração sobre seus elétrons.
Sendo assim, em uma mesma família, o raio (tamanho do átomo) aumenta de cima para baixo e em um mesmo período aumenta da direita para a esquerda.
Energia de Ionização
Energia necessária para remover um ou mais elétrons de um átomo isolado no estado gasoso: quanto maior o tamanho do átomo, menor será a energia de ionização.
- Em uma mesma família esta energia aumenta de baixo para cima;
- Em um mesmo período, a Energia de Ionização aumenta da esquerda para a direita.

Eletronegatividade
É a propriedade que um átomo possui de atrair elétrons. Na tabela periódica, a eletronegatividade aumenta de baixo para cima e da esquerda para a direita.
Essa propriedade se relaciona com o raio atômico, sendo que, quanto menor o tamanho de um átomo, maior será a força de atração sobre os elétrons.