Os sais inorgânicos são compostos iônicos, pois são formados por ligações iônicas, isto é, ligações em que há transferência definitiva de elétrons entre os íons (espécies químicas carregadas eletricamente). Esses íons de cargas elétricas opostas estão ligados por meio de forças eletrostáticas muito intensas. O íon carregado positivamente é o cátion, e o que possui carga negativa é o ânion.
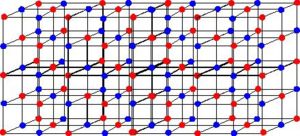
A intensa atração entre esses íons faz com que sejam formados retículos cristalinos, ou seja, aglomerados iônicos de forma geométrica bem definida, conforme o exemplo do cloreto de sódio (NaCl – sal de cozinha) mostrado a seguir:
.jpg)
Retículo cristalino do sall
Essa estrutura resulta em diversas propriedades características dos sais inorgânicos, tais como:
* Altos pontos de fusão e de ebulição: Visto que a força eletrostática que une os íons desses compostos é bem intensa, exige-se uma maior quantidade de energia para rompê-la e assim fazer com que a substância mude de estado físico, o que representa mais tempo no fogo. Isso pode ser visto no caso do próprio sal de cozinha, que possui ponto de fusão igual a 801 ºC e ponto de ebulição igual a 1413 ºC.
* Sólidos: Visto que possuem retículos cristalinos com formatos bem definidos, os sais inorgânicos são sólidos em condições de temperatura e pressão normais. Veja abaixo mais dois exemplos de sais sólidos e seus aglomerados iônicos:

Exemplos de sais sólidos e seus aglomerados iônicos
A grande maioria são sólidos cristalinos, como o próprio NaCl, porque a organização dos seus átomos é regular. Porém, existem alguns que são sólidos amorfos, cujos átomos não possuem uma organização regular, como é caso do vidro que é formado pelo aquecimento de uma mistura que leva óxido de silício. Outros sais amorfos são o BeF2 e o Cu2C2.

O vidro é um sólido amorfo
* Condutores de corrente elétrica: Isso ocorre quando estão fundidos (no estado líquido) ou em meio aquoso, pois ocorre a liberação de seus íons, que são os responsáveis pela condução da eletricidade. No estado sólido, eles não são condutores porque a estrutura rígida do retículo cristalino não permite a livre movimentação de íons.
Por exemplo, no caso do sal, se você usar um aparelho semelhante ao mostrado abaixo e colocar os fios no sal puro sólido, a lâmpada não irá ligar. No entanto, quando se dissolve o sal na água, há a dissociação iônica dos íons Na+ e Cl-, que são atraídos pelos eletrodos (fios de cobre) e fecham o circuito, conduzindo corrente elétrica, sendo assim, a lâmpada liga.
.jpg)
Aparelho que testa condutividade elétrica
* Solubilidade variável: O melhor solvente dos sais é a água, pois tanto os sais como a água são polares; mas existem outros fatores além da polaridade que afeta a solubilidade deles nos materiais, como a estrutura cristalina. Os compostos carbonatos, por exemplo, tais como o carbonato de cálcio (CaCO3), de estrôncio (SrCO3) e de bário (BaCO3), são praticamente insolúveis em água.
* Elevada dureza: Isso significa que eles são bastante resistentes ao risco;
* Baixa tenacidade: Quer dizer que os sais possuem baixa resistência a impacto ou choque mecânico, sendo sólidos quebradiços, porque, com a pressão, os íons de mesmo sinal repelem-se e o aglomerado iônico é destruído.