Os compostos iônicos são todas as substâncias formadas quando os átomos interagem por meio de uma ligação iônica. As propriedades apresentadas pelos compostos iônicos são:
-
Átomos dispostos em uma estrutura chamada retículo cristalino;
-
Sólidos em temperatura ambiente;
-
Apresentam elevada dureza;
-
Apresentam baixa tenacidade;
-
Possuem elevados pontos de fusão e ebulição;
-
Conduzem corrente elétrica quando em solução;
-
Conduzem energia elétrica nos estados líquido e gasoso.
Veja agora as particularidades de cada uma dessas propriedades dos compostos iônicos:
a) Apresentam estrutura formada por um retículo cristalino
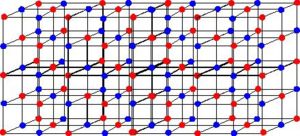
Um composto iônico apresenta sempre um grupo de cátions intercalado a um grupo de ânions, formando uma rede tridimensional regular que é chamada de retículo cristalino. A imagem a seguir mostra o retículo cristalino do cloreto de sódio (NaCl):

Representação do retículo cristalino do cloreto de sódio
Na imagem, os pontos verdes são os cátions de Sódio e os pontos rosa são os ânions de Cloro. Esses cátions e ânions interagem de forma que os íons Cloro estão sempre interagindo com mais de um íon Sódio. Por isso, temos a formação da chamada rede, na qual os átomos apresentam uma grande interação uns com os outros.
b) Sólidos em temperatura ambiente
Todos os compostos iônicos apresentam-se no estado sólido quando em condições normais de temperatura e pressão, ou seja, quando submetidos a uma temperatura de 0OC e pressão de 1 atm.
c) Apresentam elevada dureza
Dureza é a capacidade que um material apresenta de riscar outro material. No caso dos compostos iônicos, todos eles apresentam essa característica.
d) Apresentam baixa tenacidade
O termo tenacidade está relacionado com a resistência mecânica que um material apresenta quando submetido a uma força externa. Os compostos iônicos são pouco tenazes. O cristal de cloreto de sódio, por exemplo, pode ser quebrado facilmente quando sofre a ação de uma força.
e) Possuem elevados pontos de fusão e ebulição
Todo composto iônico apresenta elevados pontos de fusão e ebulição. Isso ocorre porque eles são formados pelo retículo cristalino, no qual os íons (cátions e ânions) interagem de forma eletrostática uns com os outros, ou seja, atraem-se mutuamente. Como existe uma força que mantém os íons coesos, para que eles sejam separados, é necessária uma quantidade de energia maior e, portanto, a temperatura a que o composto deve ser submetido também deve ser mais alta.
f) Conduzem corrente elétrica quando em solução
Ao ser dissolvido em um solvente, o composto iônico sofre o fenômeno da dissociação (liberação dos íons que o formam). Quando o NaCl, por exemplo, é dissolvido na água, ele dissocia-se no cátion Na+ e no ânion Cl-.
NaCl (aq) → Na+(aq) + Cl-(aq)
Como temos a presença de íons no solvente, é possível conduzir corrente elétrica por essa mistura. Dessa forma, sempre que um composto iônico for adicionado a um solvente, a solução (mistura homogênea) formada será capaz de conduzir corrente elétrica graças à presença dos íons liberados a partir do composto.
g) Conduzem energia elétrica nos estados líquido e gasoso
Quando modificamos o estado físico de um composto iônico (do estado sólido para o líquido ou gasoso), favorecemos que os átomos tenham maior mobilidade. Por terem maior mobilidade, os íons que formam o composto podem ocupar posições diferentes no espaço, o que permite a condução de corrente elétrica, o que não é possível no estado sólido, pois os íons não modificam suas posições.