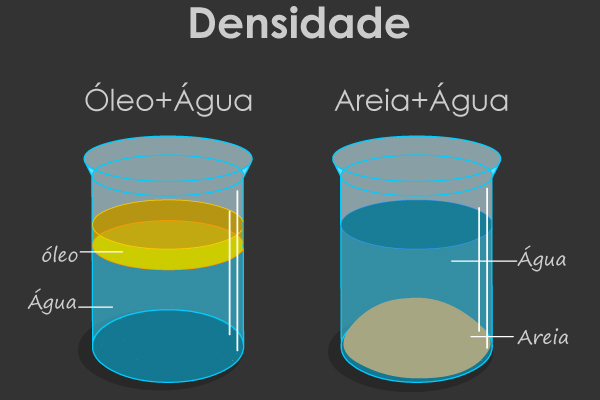
Faça o teste em casa: coloque 100 mL de água em um frasco graduado e acrescente exatamente 100 mL de álcool. Depois de misturar bem, qual é o volume que você lê no frasco no final? Com certeza, não é 200 mL, como seria de esperar. Você verá que o volume final da mistura desses dois líquidos será sempre menor que a soma deles.
Tópicos deste artigo
Por que isso acontece?
Para entendermos isso, precisamos pensar na constituição de cada uma dessas substâncias. Como mostrado abaixo, tanto as moléculas de água quanto as moléculas de álcool (etanol) possuem átomos de hidrogênio ligados a átomos de oxigênio:
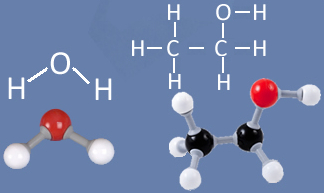
Visto que o oxigênio possui carga parcial negativa e o hidrogênio possui carga parcial positiva, o oxigênio de uma molécula atrai o hidrogênio de outra e assim sucessivamente entre várias moléculas. Desse modo, sabemos que as moléculas de água atraem-se mutualmente por meio de ligações de hidrogênio, que são forças de intensidade alta. Abaixo é mostrado como essas ligações ocorrem. Desse modo, formam-se espaços vazios entre as moléculas de água, fazendo com que ela fique mais espaçada:
.jpg)
Quando adicionamos o álcool à água, estabelecem-se ligações de hidrogênio entre as moléculas de ambas as substâncias, sendo que essa forte interação faz com que a distância entre elas diminua. Isso quer dizer que as ligações de hidrogênio entre as moléculas de água foram rompidas para que fossem estabelecidas novas ligações com o etanol, sendo assim, os espaços vazios entre as moléculas de água foram ocupados pelo álcool, diminuindo então o volume total.
É por isso que a solubilidade do álcool na água é infinita.
Isso pode ser comprovado por meio da densidade (relação entre a massa e o volume de uma substância → d = m/v). Nas condições normais de temperatura e pressão, a densidade da água líquida é de 1,0 g/cm3 e do etanol é de 0,8 g/cm3. Quando misturamos volumes iguais desses líquidos, esperaríamos que a densidade passasse a ser igual a 0,9 g/cm3. Porém, experimentalmente, verifica-se que a densidade fica em torno de 0,94 g/cm3.
Se a densidade da mistura fosse exatamente a média entre as duas densidades separadas, isso significaria que o volume e a massa dos dois líquidos não sofreram alteração. Mas não foi isso que ocorreu. Além disso, não é possível que a massa tenha aumentado do nada, restando-nos concluir que o volume é que sofreu alteração, diminuindo.
Outro aspecto interessante que pode ser observado nessa mistura é que o frasco em que elas estão fica quente, ou seja, ocorre liberação de energia na forma de calor. Isso acontece porque essa interação entre as moléculas de água e etanol é muito intensa e bastante estável, portanto, não precisam de muita energia para se manterem unidas. Já quando elas estão separadas, a estabilidade é menor, precisando de mais energia para manter as ligações de hidrogênio. Assim, visto que a energia das ligações de hidrogênio na mistura é menor que a dos líquidos separados, quando misturamos os dois líquidos, ocorre a liberação da energia excedente na forma de calor.