Já observou que ao colocarmos o gelo em um copo com água ele flutua, enquanto que em um copo com bebida alcoólica, como o uísque, ele afunda? Por que isso ocorre?
Bem, isso é explicado pela densidade dessas substâncias. Densidade é a medida da massa de uma substância pelo volume ocupado por ela:
|
d = m v |
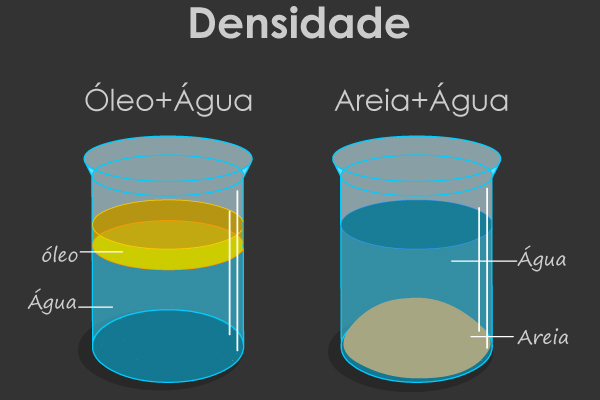
Se a densidade de determinada substância for maior, ela irá afundar na que tem menor densidade e vice-versa. A densidade da água é 1,0 g/mL, do gelo é 0,9 g/mL e do álcool é 0,7 g/mL. Dessa forma, entre o gelo e a água, o gelo tem menor densidade, por isso ele flutua. No entanto, entre o gelo e o álcool, o gelo é mais denso, por isso ele afunda.
Note que o gelo não fica totalmente em cima da água. Visto que sua densidade é 0,9 g/mL e da água é 1,0 g/mL, isso quer dizer que 90% do gelo fica debaixo da água e apenas 10% dele fica acima da superfície do líquido. Isso pode ser visto nos icebergs, que parecem ser grandes acima da superfície; no entanto, a maior parte deles está encoberta pela água.

Entretanto, surge outra pergunta:
As substâncias costumam ser mais densas no estado sólido do que no estado líquido, pois suas partículas ficam mais agrupadas; então por que a água contraria essa regra?
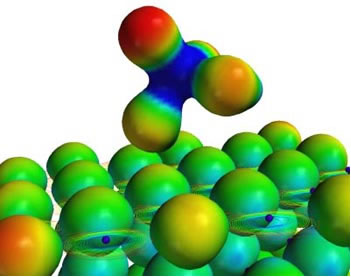
Isso se dá em razão do tipo de força intermolecular que existe entre as moléculas de água, que é a ligação de hidrogênio. A ligação de hidrogênio na água ocorre porque ela é polar, ou seja, apresenta dipolos elétricos entre seus átomos. O oxigênio é mais eletronegativo, por isso ele adquire uma carga parcial negativa (δ-), enquanto os hidrogênios possuem uma carga parcial positiva (δ+).
Por isso as suas moléculas se atraem: os hidrogênios são atraídos pelos átomos de oxigênio das moléculas vizinhas, conforme é possível visualizar na figura abaixo:

Na água líquida, as moléculas ficam dipostas tridimensionalmente, porém de modo mais espalhado. Já no gelo, essas moléculas ficam mais rígidas, de forma cristalina com espaços vazios, causados pelas ligações de hidrogênio. Esses espaços vazios são os responsáveis pela diminuição da densidade do gelo e, por isso, ele flutua na água.