Para que qualquer substância sólida se dissolva na água ou em algum líquido é necessário que as ligações existentes no sólido sejam rompidas. Para tal, é preciso que haja uma maior afinidade entre os elementos do sólido e da água do que entre os elementos do sólido somente.
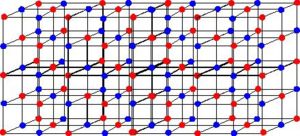
Por exemplo, o sal é um sólido – o cloreto de sódio (NaCl) – que é formado pela ligação iônica entre o sódio (Na+) e o cloro (Cl-). As moléculas do sal, por sua vez, mantêm-se atraídas umas às outras por meio de uma força intermolecular denominada interação dipolo-dipolo. As moléculas de cloreto de sódio são polares; e em virtude da distribuição de suas cargas elétricas, elas passam a ter dipolos elétricos permanentes. Isso faz com que o polo positivo de uma molécula interaja com o negativo de outra e assim sucessivamente, formando retículos cristalinos.
As moléculas de água também são polares, sendo que o polo positivo é o hidrogênio e o negativo é o oxigênio. Quando o sal é colocado em água, ela separa seus íons. Isso ocorre porque o oxigênio é mais eletronegativo que o cloro, assim o sódio será mais atraído pelo oxigênio. O mesmo ocorre com o hidrogênio, que é mais eletropositivo que o sódio, assim o cloro se desliga do sódio e é atraído pelo hidrogênio.
Observe isso ocorrendo nas moléculas abaixo:
.jpg)
Esse exemplo serviu para mostrar que se quisermos dissolver um sólido em um líquido, as partículas do líquido precisam oferecer boas interações de conexão com as partículas individuais do sólido. Somente dessa forma as partículas do sólido irão se separar para formar novas ligações com as partículas do líquido e ficar mais estáveis do que antes.
No caso dos metais, como o ferro, suas partículas estão todas bem unidas com uma atração bem forte e estável. A sua ligação química é a metálica, que é mantida por meio de elétrons livres que transitam no reticulado cristalino, nas grades ou células do metal. Os átomos que perderam esses elétrons transformam-se em cátions, os quais, logo em seguida, podem novamente receber um dos elétrons livres e se tornar um átomo neutro. Esse processo continua indefinidamente, criando uma contínua nuvem de elétrons que funciona como uma ligação que mantém os átomos unidos e bem agrupados.
Além disso, normalmente substâncias sólidas que se dissolvem umas nas outras são parecidas. Por exemplo, conforme visto no caso do sal e da água, ambos eram polares. E é isso que é verificado normalmente: substâncias polares dissolvem outras que também são polares; e apolares dissolvem apolares. Outro ponto é que os sólidos se dissolvem, tornando-se algo similar. Isso ocorre porque há oportunidades similares de conexão entre as partículas do sólido e do líquido.
Entretanto, o ferro e a água são substâncias com propriedades totalmente diferentes. Podemos observar que a água não é boa para dissolver nem ferro, nem alguns outros metais. Não há atração ou afinidade química entre eles. O ferro não permite que a água penetre em suas ligações para quebrá-las, ou seja, a água não se sente atraída por esses compostos.