As moléculas são compostas de elementos unidos por meio de ligações covalentes, ou seja, por meio do compartilhamento de um ou mais pares de elétrons.
Em moléculas de compostos simples, isto é, que possuem o mesmo elemento e consequentemente a mesma eletronegatividade, dizemos que essa ligação é apolar.

Exemplos: H2,F2,O2,Cl2 e N2.

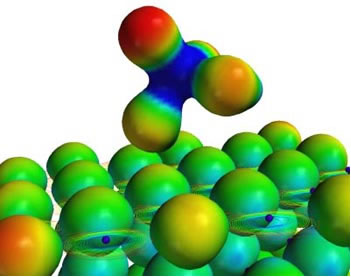
Quando a ligação covalente se dá entre elementos de eletronegatividades diferentes, o elemento mais eletronegativo atrai para si com maior intensidade o par de elétrons compartilhado, dessa maneira, a densidade da carga negativa é deslocada. Forma-se um dipolo elétrico, que resulta em uma carga parcial positiva (δ+) e uma carga parcial negativa (δ-) de mesma intensidade.

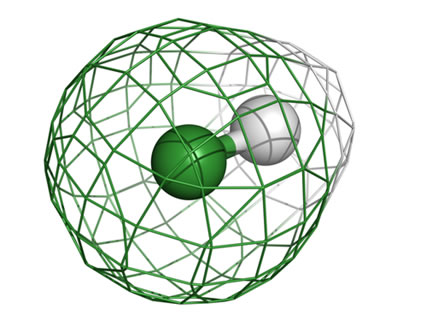
Um exemplo é o cloreto de hidrogênio (HCl) - mostrado a seguir, onde o elemento mais eletronegativo é o cloro, desse modo ele atrai mais o par eletrônico. Portanto, nesse tipo de ligação, os pares de elétrons estão mais próximos do elemento mais eletronegativo, no caso, o cloro.

Outros exemplos de ligações covalentes polares:

Aproveite para conferir nossa videoaula relacionada ao assunto: