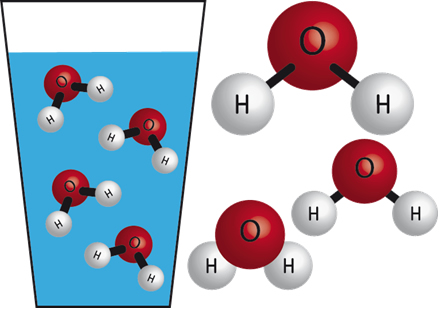
Os compostos no cotidiano apresentam diferentes propriedades, tais como estado de agregação (sólido, líquido e gasoso) à temperatura ambiente, pontos de fusão e ebulição e solubilidade. Falando, por exemplo, da solubilidade, algumas substâncias dissolvem em uns solventes, mas em outros não. O álcool etílico dissolve em água e na gasolina, mas a gasolina não se dissolve em água.
Essas diferenças ocorrem, entre outros fatores, porque, numa molécula, diferentes ligações podem ocorrer, sendo que algumas serão polares e outras apolares. Vamos ver como identificar se uma ligação química é polar ou apolar:
- Ligações iônicas:
Uma ligação iônica se forma pela transferência definitiva de um ou mais elétrons de um elemento para outro, com a formação de íons. O átomo do elemento que doa os elétrons adquire carga positiva, tornando-se um cátion, e o átomo do elemento que recebe os elétrons se torna negativo, sendo chamado de ânion.
Visto que em toda ligação iônica há a presença de íons com excesso de cargas elétricas opostas (positiva e negativa), essas ligações sempre serão polares.
- Ligações covalentes:
A ligação covalente se dá pelo compartilhamento de pares de elétrons.
Se ela ocorrer entre átomos de um mesmo elemento químico, a ligação será apolar.
Por exemplo, abaixo temos a ligação covalente entre dois átomos de oxigênio, formando uma molécula de gás oxigênio, O2. Visto que ela é formada por átomos do mesmo elemento, não há diferença de eletronegatividade entre eles e os elétrons serão atraídos da mesma forma pelos dois núcleos. Com isso, não há o acúmulo de carga elétrica em nenhum dos polos da molécula, sendo, portanto, apolar:

?Outros exemplos de ligações covalentes apolares são: H2, F2, N2 e C?2.
Se a ligação covalente ocorrer entre átomos de elementos químicos diferentes, a ligação será polar.
Por exemplo, a seguir temos a ligação covalente que forma a molécula de cloreto de hidrogênio, HC?. O cloro é mais eletronegativo que o hidrogênio, por isso ele atrai os elétrons para si com maior intensidade, adquirindo um “caráter” negativo, simbolizado por δ-, enquanto o átomo de hidrogênio adquire um “caráter” positivo, δ+. Esse dipolo elétrico que é formado devido à diferença de eletronegatividade entre os elementos faz com que a ligação seja polar:
.jpg)
É importante ressaltar que, nas ligações covalentes polares, deve-se representar o polo negativo por δ- e o polo positivo por δ+, e não pelos sinais (+) e (-), porque isso passaria a ideia errada de que a espécie química é constituída de cátions e ânions, isto é, que a ligação é iônica. A letra delta indica que se trata de uma ligação covalente, cuja distribuição de carga não é uniforme.
Outros exemplos de ligações covalentes polares são: HF e HBr.
Resumidamente, temos então:

A polaridade das ligações aumenta neste sentido:

Mas, entre as ligações covalentes polares, qual apresenta maior polaridade?
A polaridade de uma ligação aumenta proporcionalmente ao aumento da diferença de eletronegatividade entre os átomos dos elementos que participam da ligação.
Por meio de medidas experimentais, o cientista Linus Pauling criou uma escala de eletronegatividade para os elementos da Tabela Periódica, que pode ser vista a seguir:

As setas indicadas, que mostram o sentido do crescimento da eletronegatividade dos elementos (da esquerda para a direita e de cima para baixo), e a parte mais escura indicam os elementos mais eletronegativos. Considerando esses elementos mais importantes, a escala pode ser representada simplificadamente por:

Assim, entre as ligações covalentes polares de HF, HC? e HBr, a de maior polaridade é a do HF, pois o hidrogênio e o flúor estão nas extremidades da escala, ou seja, a diferença de eletronegatividade entre eles é a maior. Depois, a polaridade mais intensa é a do HC? e, por último, a do HBr.
Essa diferença de eletronegatividade (?) pode ser calculada. Por exemplo, no caso das ligações covalentes apolares, esse valor é igual a zero:
C? ? C?
? = 3,0 - 3,0 = zero
? = 3,0 - 3,0 = zero
Já nas ligações polares, este valor será diferente de zero. Se ele for menor ou igual a 1,6, a ligação será predominantemente covalente, como nos casos abaixo:
H ? C? I ? F
2,1 3,0 2,5 4,0
? = 3,0 – 2,1 = 0,9 ? = 4,0 – 2,5 = 1,5 (essa ligação é mais polar que a anterior)
No entanto, se o valor da diferença de eletronegatividade (?) for maior que 1,6, a ligação será predominantemente iônica. Exemplos:
Na+ C?- K+ F-
0,9 3,0 0,8 4,0
? = 3,0 – 0,9 = 2,1 ? = 4,0 – 0,8 = 3,2
Outro fato importante a se observar é que a carga parcial (δ) dos átomos de cada elemento não pode ser definida como um único valor, mas ela pode variar, dependendo de qual elemento está ligado a ele. Por exemplo, o hidrogênio possui caráter zero (δ0) na molécula de H2, enquanto na molécula de HC?, sua carga é de +1 (δ+1).
Aproveite para conferir nossas videoaulas relacionadas ao assunto: