A primeira pilha conhecida foi desenvolvida por Alessandro Volta (1745-1827) em 1800. Conforme se pode ver na figura abaixo, ela era constituída de placas metálicas de zinco e de cobre intercaladas e divididas por um algodão embebido numa solução eletrolítica que conduzia a corrente elétrica entre as placas, isto é, conduzia os elétrons perdidos pelo zinco até o cobre. Cada placa era um eletrodo e cada conjunto dessas duas placas e o algodão era chamado de célula ou cela eletrolítica.
 ?
?
Mas as soluções eletrolíticas usadas por Volta eram ácidas e geravam gases tóxicos, sendo muito perigosas. Assim, em 1836, o químico inglês John Frederic Daniell (1790-1845) aperfeiçoou essa descoberta e montou um novo tipo de pilha menos arriscada e que ficou conhecida como Pilha de Daniell.

Químico e meteorologista inglês John Frederic Daniell (1790-1845)
Ele fez o seguinte: num recipiente, ele colocou uma lâmina de zinco numa solução de sulfato de zinco (ZnSO4); em outro recipiente separado, ele colocou uma lâmina de cobre numa solução de sulfato de cobre (CuSO4). Dessa forma, ele fez o eletrodo de zinco e o eletrodo de cobre. Cada eletrodo desses é chamado de semicela.
Separadamente ocorrem reações de oxirredução em cada sistema, com transferência de elétrons entre as espécies químicas, como será explicado mais adiante. Porém, desse modo, não era possível aproveitar a transferência de elétrons para gerar corrente elétrica e ligar uma lâmpada, por exemplo. Por isso, ele colocou um circuito externo ligando esses dois eletrodos, com uma pequena lâmpada no meio.
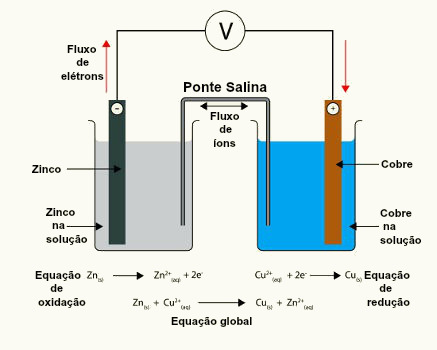
Além disso, interligou as soluções de sulfato de cobre e de zinco com uma ponte salina que servia para manter as semicelas eletricamente neutras através da migração de íons. Sem a ponte salina haveria um excesso de cargas positivas em ambos os lados do sistema e a reação pararia precocemente.
A ponte salina pode ser um tubo de vidro em U com uma solução de sulfato de potássio (K2SO4), de nitrato de sódio (NaNO3), de nitrato de amônio (NH4NO3) ou de cloreto de potássio (KCl).
Observe o esquema da pilha de Daniell abaixo:

Com o passar do tempo, observou-se que a placa de zinco era corroída e a placa de cobre aumentava de massa, enquanto a solução de sulfato de cobre, que era azul, ia ficando incolor:

Isso ocorreu devido às reações de oxirredução, onde há transferência de elétrons entre os eletrodos. Veja como isso se dá:
- Funcionamento da pilha de Daniell:
* Ânodo (placa de zinco) – O zinco metálico tem maior potencial de oxidação que o cobre, por isso ele perde 2 elétrons que são conduzidos para os eletrodos de cobre. Com isso, o zinco metálico (Zn0(s)) sofre oxidação e se transforma no cátion zinco (Zn2+(aq)), que fica na solução. É por isso que a placa de zinco vai perdendo massa com o passar do tempo e a quantidade de cátions Zn2+ aumentam na solução de sulfato de zinco.
Portanto, a placa de zinco é o polo negativo da pilha, onde ocorre a oxidação, sendo denominado de ânodo.
Semirreação do ânodo: Zn( s) ↔ Zn2+(aq) + 2 e-
* Cátodo (placa de cobre) – O cobre metálico tem maior potencial de redução que o zinco, por isso ele recebe os 2 elétrons que o zinco perdeu. Com isso, os cátions cobre (Cu2+(aq)), que estavam na solução de sulfato de cobre, sofrem redução e se transformam em cobre metálico (Cu0(s)), que se deposita na placa. É por isso que, com o passar do tempo, a massa da placa de cobre vai aumentando. Além disso, a cor azul da solução de sulfato de cobre se deve à presença dos íons Cu2+. Visto que eles vão diminuindo em solução, a sua cor vai se tornando transparente com o passar do tempo.
Dessa maneira, a placa de cobre é o polo positivo da pilha, onde ocorre a redução, sendo denominado de cátodo.
Semirreação do cátodo: Cu2+(aq) + 2 e- ↔ Cu( s)
Reação Global da Pilha: Cu2+(aq) + Zn( s) ↔ Zn2+(aq) + Cu( s)
A notação química ou representação da pilha de Daniell é feita da seguinte forma:
Zn / Zn2+// Cu2+ / Cu
Aproveite para conferir nossa videoaula sobre o assunto: