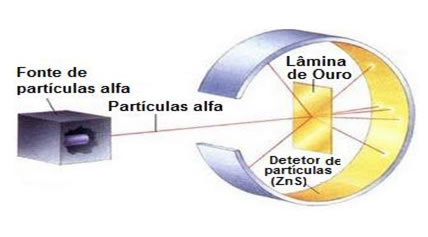
Em 1911, o físico neozelandês Ernest Rutherford realizou um experimento em que ele bombardeou uma finíssima lâmina de ouro com partículas alfa (α) emitidas por uma amostra de polônio (material radioativo), que ficava dentro de um bloco de chumbo com um pequeno orifício pelo qual as partículas passavam.
O ouro foi escolhido por ser um material inerte, pouco reativo. Até o momento, acreditava-se que o átomo seria uma esfera carregada positivamente, com elétrons (partículas negativas) distribuídos uniformemente por todo o seu volume, conforme indicava o modelo de Thomson.
.jpg)
Se o átomo fosse realmente assim, as partículas alfa, que são compostas por partículas positivas, atravessariam os átomos da lâmina de ouro e, no máximo, algumas sofreriam pequenos desvios em suas trajetórias ao se aproximarem dos elétrons.

Mas não foi isso que Rutherford observou. A grande maioria das partículas atravessava a lâmina de ouro, uma quantidade pequena não atravessa a folha, mas voltava, e algumas partículas alfa sofriam desvios de suas trajetórias.
.jpg)
Isso comprovou que o modelo de Thomson estava incorreto. A partir das informações coletadas, Rutherford propôs o seu modelo atômico, que foi o seguinte:
- Visto que a maioria das partículas alfa atravessou os átomos da lâmina de ouro, isso significa que os átomos possuem uma grande parte vazia. Nesse espaço vazio ficam os elétrons e, por isso, esse espaço foi chamado de eletrosfera.
- Poucas partículas alfa refletiam e desviavam porque o átomo possui um núcleo bem pequeno e condensado, onde está toda a massa do átomo, não permitindo que as partículas atravessem. Esse núcleo seria positivo, pois as partículas alfa também são positivas, então, quando elas estivessem passando perto do núcleo, elas sofreriam um desvio em sua trajetória, pois cargas de mesmo sinal se repelem. Mas, se batessem de frente com o núcleo, elas seriam ricocheteadas, rebatidas na direção contrária ao choque.
- Comparando o número de partículas que atravessou a lâmina com as que foram rebatidas, conclui-se que o núcleo é de 10 000 a 100 000 vezes menor que seu tamanho total.
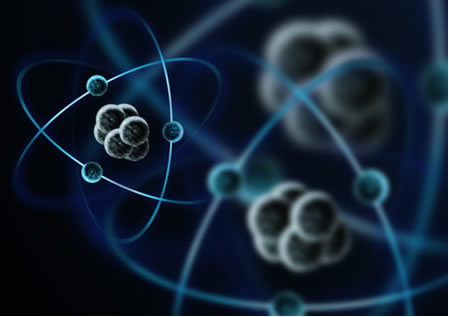
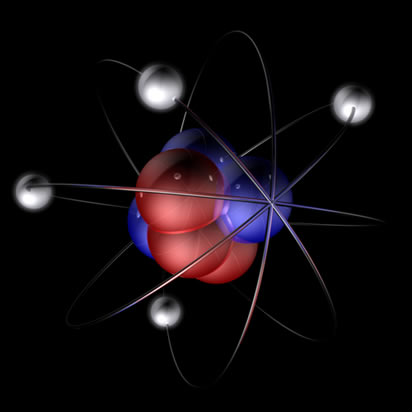
Resumidamente, o modelo de Rutherford era parecido com o sistema solar, em que o núcleo positivo (feito de prótons) seria o sol e os planetas que giram ao seu redor seriam os elétrons na eletrosfera:
.jpg)
Em 1932, Chadwick descobriu a terceira partícula subatômica, o nêutron, e o modelo de Rutherford sofreu uma pequena alteração, em que o núcleo não era composto apenas de prótons, mas de nêutrons também. Ele continuava positivo porque os nêutrons não possuem carga alguma, apenas impediam que a repulsão entre os prótons deixasse o átomo instável.
Assim, o átomo de Rutherford ficou como o mostrado na imagem a seguir. Lembrando que o núcleo não está na proporção correta com o diâmetro do átomo.

Esse modelo é muito útil até hoje para explicar vários fenômenos físicos e químicos. No entanto, ele apresentava uma série de contradições consideráveis, como o fato de que cargas opostas se atraem e, dessa forma, se os elétrons (negativos) girassem ao redor do núcleo (positivo), eles perderiam energia gradualmente e adquiririam uma trajetória em forma de espiral até atingir o núcleo.
Assim, o modelo atômico continuou evoluindo, como mostra o texto abaixo:
* Créditos da imagem: rook76 / Shutterstock.com