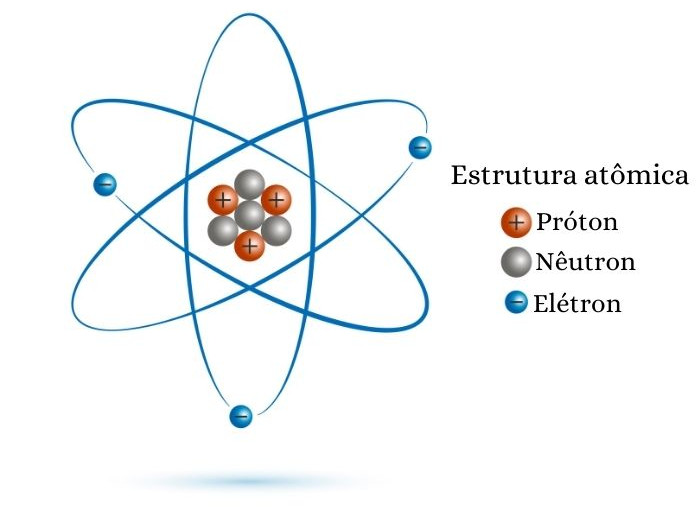
Número atômico, representado comumente pela letra Z, representa o número de prótons no núcleo de uma espécie atômica. O número atômico serve para identificar a qual elemento químico pertence a espécie atômica, pois, atualmente, os elementos químicos são diferenciados pelo número de prótons em seu núcleo.
O número atômico foi proposto pelo cientista inglês Henry Moseley, em 1913, após experimentos com mais de 40 elementos químicos e suas emissões de raios X. Seus estudos remodelaram a Tabela Periódica de Mendeleiev, fazendo com que os elementos fossem descritos em ordem crescente do número atômico, e não de suas massas atômicas. Dessa forma, as propriedades periódicas ficaram estabelecidas em função do número atômico.
Veja também: Isótopos, isótonos, isóbaros e isoeletrônicos — classificações de alguns conjuntos de átomos
Tópicos deste artigo
- 1 - Resumo sobre número atômico
- 2 - O que é número atômico?
- 3 - Como se calcula o número atômico?
- 4 - Diferenças entre o número atômico e o número de massa
- 5 - Importância do número atômico
- 6 - Número atômico e as reações nucleares
- 7 - História do número atômico
- 8 - Exercícios resolvidos sobre número atômico
Resumo sobre número atômico
-
É numericamente igual ao número de prótons no núcleo de uma espécie atômica.
-
É representado pela letra Z.
-
Serve para determinar a carga elétrica do núcleo.
-
Utiliza-se para diferenciar os elementos químicos.
-
Foi proposto por Henry Moseley.
-
Sua concepção permitiu remodelar a Tabela Periódica e fazer correções.
O que é número atômico?
O número atômico é a medida da carga elétrica positiva do núcleo atômico, ou, de forma semelhante, o número de prótons de uma espécie atômica (seja um íon ou um átomo). Essa grandeza é representada pela letra Z e é utilizada para identificar o elemento químico a que a espécie atômica pertence.
Como se calcula o número atômico?
O número atômico é igual ao número de prótons no núcleo. Sendo assim, para conhecer o valor de Z, basta saber o número de prótons que a partícula atômica possui em seu núcleo. Por exemplo, um átomo que possui oito prótons no núcleo tem um número atômico igual a oito (Z = 8).
Outra forma de cálculo do número atômico é se aproveitar do número de elétrons. Sabe-se que um átomo é uma espécie eletricamente neutra, ou seja, possui o mesmo número cargas positivas (prótons) e negativas (elétrons). Assim, se um átomo possui 30 elétrons, por ser eletricamente neutro, também terá 30 prótons e, consequentemente, Z = 30.
Deve-se ter cautela no cálculo do número atômico pelo número de elétrons no caso de íons, espécies atômicas carregadas positivamente ou negativamente, consequência de perda ou ganho de elétrons. Por exemplo, o cátion divalente do cálcio (Ca2+) possui 18 elétrons. Isso significa que, para se tornar esse íon, o átomo de cálcio teve que perder dois elétrons, isto é, o átomo de cálcio, Ca, possui 20 elétrons. Sendo um átomo, pode-se afirmar que é eletricamente neutro, tendo o mesmo número de prótons e elétrons. Assim, o número atômico do cálcio é igual a 20.
Diferenças entre o número atômico e o número de massa
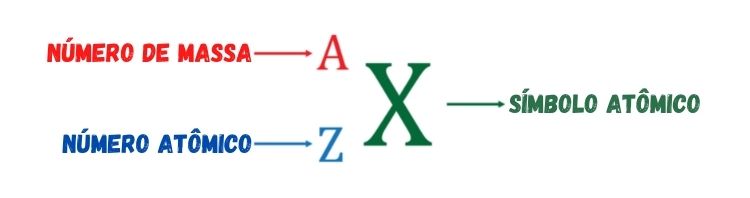
Como dito anteriormente, o número atômico mede a carga elétrica positiva do núcleo atômico ou o número de prótons da espécie atômica. O número de massa, representado pela letra A, é um número inteiro resultante da soma do número de prótons com o número de nêutrons. Recebe esse nome porque, dentre as três partículas constituintes do átomo — prótons, elétrons e nêutrons —, apenas prótons e nêutrons possuem massa significante, sendo a massa do elétron desprezível em relação à massa dos prótons e dos nêutrons.
O número de massa têm grande importância, pois é utilizado para diferenciar os isótopos de um mesmo elemento químico, já que essas espécies possuem o mesmo número atômico. Já a média ponderada dos números de massa de todos os isótopos existentes de um mesmo elemento químico gera os valores de massas atômicas presentes na Tabela Periódica.
-
Videoaula sobre determinação do número de partículas de um átomo
Importância do número atômico
O número atômico foi importante para organizar os elementos adequadamente na Tabela Periódica. Antes de ser determinado, a tabela organizava os elementos em ordem crescente de massa, o que gerava algumas incoerências. Por exemplo, o iodo, com peso atômico de 126,9, deveria vir antes do telúrio, de peso atômico 127,6, porém isso não acontecia.
Assim, as propriedades químicas dos elementos passaram a ser entendidas como funções periódicas do número atômico e não mais de seus pesos atômicos, como havia proposto o criador da Tabela Periódica, Dmitri Mendeleev.
O estabelecimento do número atômico também foi importante para se determinar o número de elétrons do átomo, uma vez que, sendo eletricamente neutro, a carga elétrica positiva do núcleo é igual à carga elétrica negativa do átomo.
Número atômico e as reações nucleares
Frederick Soddy e Ernest Rutherford foram os responsáveis, em 1903, pela Lei de Transformação Radioativa, que demonstrava que a desintegração de um átomo pesado teria, como produto, átomos mais leves, como consequência de emissões alfa.
As emissões alfa são emissões de uma partícula nuclear, chamada de alfa (ɑ), que contém dois prótons e dois nêutrons. A cada partícula alfa emitida, o átomo teria quatro unidades a menos de número de massa e duas unidades a menos de número atômico, como pode ser visto na imagem abaixo.
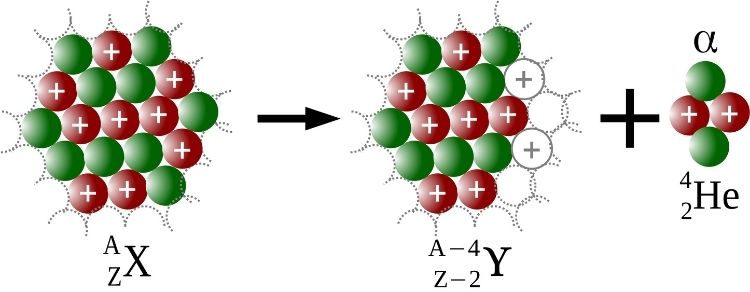
Por causa da desintegração radioativa, Rutherford ganhou, em 1908, o Prêmio Nobel de Química. Já Soddy foi quem cunhou, em 1913, o termo isótopos, investigação que lhe rendeu o Prêmio Nobel de Química de 1921. Resolveu-se, assim, o problema de se colocar na Tabela Periódica os inúmeros novos “elementos”, os quais, na verdade, não passavam de isótopos.
Posteriormente, a transmutação dos elementos foi alcançada de forma artificial, em 1925, pelo assistente de Rutherford, Patrick Blackett. Hoje, sabe-se que diversas reações nucleares, como as desintegrações, transmutações, fissões e fusões, são capazes de alterar o número atômico de uma espécie.
Leia também: Leis da radioatividade — estudos do comportamento de um átomo ao emitir radiação alfa ou beta
História do número atômico
Henry Gwyn Jeffreys Moseley, em 1910, aos 23 anos de idade, chegou à Universidade de Manchester, Inglaterra, onde havia sido admitido pelo grupo de trabalho do físico neozelandês Ernest Rutherford. Inspirado pelos estudos de William Brag com raios X, Moseley acreditava que a investigação dos raios X e suas propriedades poderiam trazer novas contribuições para a estrutura atômica.
Em conjunto com o neto do naturalista inglês Charles R. Darwin, o físico Charles G. Darwin, Moseley percebeu que a radiação X produzida por um alvo de platina gerava frequências que eram características da própria platina, convencendo-se ainda mais de que tais raios X característicos seriam um meio de descobrir mais sobre os segredos da estrutura atômica.
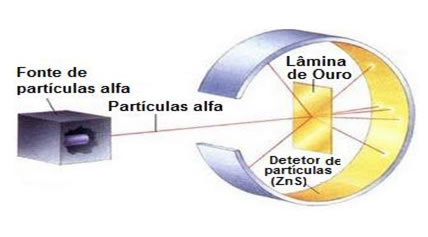
Apesar de Darwin ter seguido outro caminho, Moseley continuou com seu projeto e tentou utilizar seus conhecimentos para investigar mais sobre o núcleo atômico, região inserida pelo modelo atômico de Rutherford. As medidas de espalhamento das partículas alfa por finíssimas lâminas metálicas não permitiam que o grupo do físico neozelandês determinasse a quantidade de carga elétrica positiva do núcleo.
Até que, em 1913, o advogado e físico amador holandês van den Broek, escrevendo para a revista Nature, propôs que todas as propriedades químicas e ópticas de um elemento (inclusive os raios X característicos) seriam determinadas pelo seu “número atômico”, isto é, o número de ordem da posição do elemento na Tabela Periódica, e não pelo seu peso atômico. A ideia trazida por Broek chamou a atenção de Frederick Soddy e Ernest Rutherford, que julgaram a ideia bastante promissora.
Moseley ficou determinado a testar a “hipótese de Broek” e, após experimentos com dez elementos entre o cálcio e o zinco, concluiu que a frequência (ou comprimento de onda) dos raios X característicos crescia de acordo com o número atômico, e não com o peso atômico, conseguindo validar a hipótese de Broek.
Os experimentos de Moseley foram essenciais para identificar elementos químicos e, inclusive, auxiliar na descoberta de novos, como foi o caso dos elementos tecnécio, promécio, háfnio e rênio. Através dos raios X característicos, também foi possível identificar a composição química de materiais, como uma liga de latão (composta por cobre e zinco), comparando-a com os resultados das substâncias simples.

Porém, a vida de Henry Moseley logo chegou ao fim. Patriota, apresentou-se como voluntário para se tornar combatente do exército britânico na Primeira Guerra Mundial, iniciada em 1914, contrariando as sugestões de sua mãe, de Rutherford e do próprio exército britânico. Em 10 de agosto de 1915, aos 27 anos, Moseley foi mortalmente atingido por uma bala em sua cabeça, durante uma batalha contra o exército turco na península de Gallipoli.
Apesar de uma curta carreira científica, não se pode negar o quão brilhante ela foi. Graças a Moseley, podemos hoje saber a quantidade de carga elétrica contida no núcleo atômico, o conceito correto de número atômico e como isso influenciava na periodicidade das propriedades dos elementos químicos, mostrar a independência entre número atômico e peso atômico, antecipar a existência de novos elementos químicos, além de criar um método não destrutivo para descobrir a composição de materiais.
-
Videoaula sobre modelos atômicos
Exercícios resolvidos sobre número atômico
Questão 1
(UERJ 2013) A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da matéria.
Sabe-se, hoje, que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a
A) 0,5.
B) 1,0.
C) 1,5.
D) 2,0.
Resolução:
Alternativa C
Como são dois isótopos, a carga elétrica nuclear (número atômico) é a mesma para ambas as espécies. Assim, a divisão (razão) entre os números atômicos é igual a 1,0, pois os valores são idênticos.
Questão 2
(UERJ 2015) Com base no número de partículas subatômicas que compõem um átomo, as seguintes grandezas podem ser definidas:
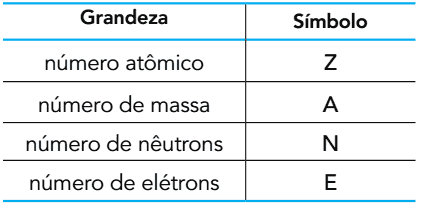
O oxigênio é encontrado na natureza sob a forma de três átomos: 16O, 17O e 18O. No estado fundamental, esses átomos possuem entre si quantidades iguais de duas das grandezas apresentadas.
Os símbolos dessas duas grandezas são
A) Z e A.
B) E e N.
C) Z e E.
D) N e A.
Resolução:
Alternativa C
Como se trata de três átomos que, na verdade, são isótopos (pois pertencem ao mesmo elemento químico, oxigênio), podemos concluir que os três possuem o mesmo número atômico Z. Como são átomos, ou seja, estão no estado fundamental, são eletricamente neutros, o que quer dizer que a carga elétrica total é igual a zero. Em outros termos, isso significa que o número de prótons é igual ao número de elétrons. Assim, se essas espécies possuem números atômicos iguais, elas também terão números de elétrons iguais (E).