Os químicos trabalham com aspectos quantitativos que podem ser vistos e tocados, ou seja, quantidades macroscópicas, tais como massa em gramas e volume em litros, mas eles também trabalham com quantidades microscópicas, pois seus estudos envolvem o que ocorre com os átomos e moléculas que compõem as substâncias e que explicam os fenômenos macroscópicos.
Mas como é possível medir a massa de um átomo? Qual seria o padrão de medida de massa para os átomos?
Obviamente, é inviável para os químicos pesarem em uma balança os átomos, íons ou moléculas.
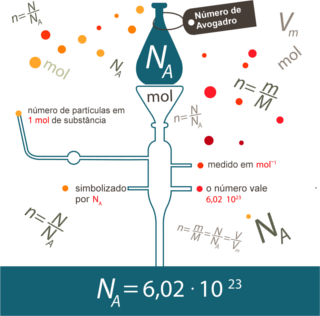
Para solucionar esse problema surgiu o conceito de mol, que funciona como uma espécie de ponte, ligando o mundo macroscópico com o mundo microscópico. Por isso, ele é tão importante em Química.
Para entender o que significa essa grandeza, pense, por exemplo, que você trabalha empacotando miçangas, que são objetos bem pequenos usados na confecção de bijuterias. Digamos que em cada pacote tem que haver 1 000 miçangas. Como você faria para realizar essa contagem de uma forma mais fácil e eficiente?
Contar as miçangas uma por uma daria muito trabalho, assim, uma forma mais adequada seria estabelecer um padrão de referência com uma quantidade de fácil manuseio. Por exemplo, poderia medir a massa de 10 miçangas em uma balança e, então, descobrir qual será o peso de 1000 miçangas. Digamos que 1 000 miçangas correspondam a 90 gramas, então, 90 gramas seria o seu padrão de referência, pois com base nele podemos descobrir quantas miçangas há em qualquer massa.

Nesse caso, contamos grandes unidades por meio da massa. No caso do exemplo, a grandeza usada foi “quantidade de miçangas”. Já no caso da numerosidade das espécies químicas, ou seja, no caso da quantidade de átomos, moléculas, íons, elétrons ou fórmulas, a grandeza utilizada passou a ser denominada de quantidade de matéria, sendo representada pela letra n e a unidade utilizada é o mol.
O padrão de referência de massa a que o mol é relacionado é 12 gramas de carbono-12:
.jpg)
O carbono-12 (12C) é o isótopo do elemento carbono mais abundante na natureza (98,94%) que contém 6 prótons, 6 nêutrons (número de massa (A) igual a 12) e 6 elétrons. Os outros isótopos de carbono que existem em menor porcentagem na natureza são o carbono-13 e o carbono-14.
A massa de 12 g de 12C possui exatamente a massa atômica igual a 12 u. Isso garante que a quantidade de 1 mol de qualquer átomo corresponda ao valor da sua massa atômica, expresso em gramas. Por exemplo, a massa atômica do hidrogênio é aproximadamente igual a 1 u, o que significa que a massa de um átomo de 12C é 12 vezes superior à de um átomo de hidrogênio. Além disso, a massa molar do H será 1 g.
No caso de substâncias, a massa de 1 mol será o valor da massa molecular (soma das massas atômicas) em gramas.
Por exemplo, conforme já dito, a massa atômica do H é 1,0 u e a massa atômica do O é 16,0 u. Assim, a massa molecular da água será:
H2O – (2 . 1,0) + (1 . 16,0) = 18,0 g/mol
Temos, então, que em 1 mol de água há 18 gramas.
O carbono-12 foi estabelecido como padrão em 1957 pela IUPAC (União Internacional da Química Pura e Aplicada) e foi escolhido por ser abundante e estável.
Mas, até aqui, relacionamos o mol com a massa, como seria possível contar as unidades de partículas que determinada massa de espécie química possui? Por exemplo, quantas moléculas existem em 1 mol de água (ou em 18 gramas de água)?
É aí que entra a relação entre o mol e o número de Avogadro. Os químicos usam o mol para determinar a quantidade de entidades (átomos, moléculas, íons, fórmulas ou elétrons) que há em determinada massa molar. A palavra mol representa um número – 6,022 . 1023, que é o valor da constante de Avogadro.

O químico italiano Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) foi o primeiro cientista a conceber a ideia de que uma amostra de um elemento, com massa em gramas numericamente igual à sua massa atômica, apresenta sempre o mesmo número de átomos. Ele próprio não conseguiu determinar qual número seria esse, mas, ao longo do século XX, experimentos foram feitos para se descobrir esse número e, quando ele foi finalmente determinado - 6,022 . 1023 –, chamaram-no de constante de Avogadro em homenagem a esse cientista.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
A relação entre o mol, o número de Avogadro e a massa atômica é muito importante, pois se soubermos qualquer uma destas três coisas – mols, quantidade de partículas ou gramas –, podemos determinar as outras duas.
Por exemplo, quantas moléculas existem em 1 mol de água?
Relacionando com o número de Avogadro, sabemos que existem 6,022 . 1023 moléculas de H2O em 1 mol de água ou podemos dizer também que em 18 g de água encontramos 6,022 . 1023 moléculas de água.
Veja mais dois exemplos:
Exemplo 1: Qual a massa presente em 1,5 mol de átomos de Fe?
A massa molar do ferro é igual a 55,85 g/mol, então:
1 mol ------- 55,85 g de Fe
1,5 mol ----- x
x = 55,85 . 1,5
x = 83,775 g de Fe
A massa presente em 1,5 mol de átomos de Fe é de aproximadamente 83,775 gramas.
Exemplo 2: Qual é a quantidade de matéria existente em um amostra de 80 g de metano (CH4)?
- Cálculo da massa molecular do metano:
CH4 = (1 . 12,0) + (4 . 1,0) = 16,0 g/mol
1 mol ----- 16,0 g
x ----------- 80
x = 80/16
x = 5 mol