O cientista dinamarquês especializado em Física, Niels Bohr, realizou algumas observações referentes ao estudo da luz e, baseado em suas conclusões, ele pôde aprimorar o modelo atômico de Rutherford.
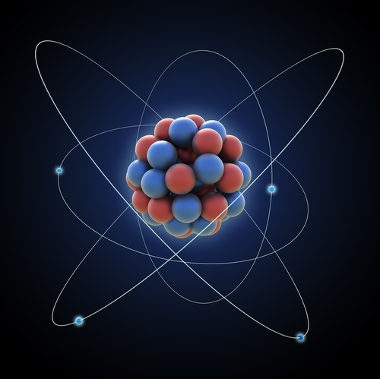
O modelo atômico de Rutherford-Bohr ficou assim conhecido porque Bohr manteve as principais características do modelo de Rutherford, porém acrescentou mais informações sobre os elétrons que ficavam ao redor do núcleo.
Segundo Bohr, os elétrons só podem permanecer em determinadas órbitas que possuem estados de energia fixos, constantes; pois os elétrons recebem e emitem o que Max Planck chamou de quanta, ou seja, pacotes discretos de energia.
.jpg)
Isso significa que cada órbita do átomo contém uma determinada quantidade de energia, e só o elétron que possui aquela energia é que pode permanecer ali. Quanto mais próximo do núcleo, menor será essa energia.

O estado de menor energia em que um elétron se encontra é denominado estado fundamental. Esse elétron só poderá passar para um estado de maior energia, ou seja, para uma órbita mais externa ao núcleo, se ele receber a quantidade necessária de energia. Se isso ocorrer, ele estará no seu estado excitado, que é muito mais instável.
Quando esse elétron retorna ao estado de energia mais estável, que é o fundamental, ele emite certa quantidade de energia radiante, que pode ser vista na forma de luz.
Essas órbitas permitidas para os elétrons foram denominadas órbitas, níveis ou camadas energéticas ou eletrônicas. E foram definidas como sendo no máximo sete, que podem também ser representadas, respectivamente, do mais interno para o mais externo, pelas letras: K, L, M, N, O, P e Q.

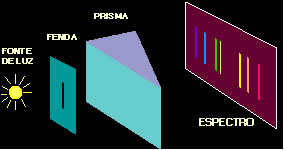
Cada elemento apresenta diferentes valores de energia para as suas camadas, é por isso que cada elemento possui um espectro diferente e uma cor diferente na liberação da radiação eletromagnética em forma de luz visível.