Os elementos químicos são formados, cada um, por um ou mais átomos que possuem o mesmo número atômico, isto é, a mesma quantidade de prótons em seu núcleo. Por exemplo, o elemento hidrogênio é formado por átomos com número atômico igual a 1, enquanto o oxigênio é formado por átomos de número atômico igual a 8.
Mas esses elementos (iguais ou diferentes) podem se combinar formando moléculas ou aglomerados iônicos (os íons são átomos ou grupos de átomos com carga elétrica), que formam as substâncias puras.
Por exemplo, quando dois átomos de hidrogênio se unem a um átomo de oxigênio é formada uma molécula, representada pela fórmula molecular H2O, que é a substância química da água. Outro exemplo de substância pura é o cloreto de sódio (NaC?), principal componente do sal de cozinha. Ele não é formado por moléculas, como no caso da água, mas sim por aglomerados de um número muito grande de íons positivos (Na+) e negativos (C?-), que ficam unidos eletricamente.
As substâncias puras podem ser definidas da seguinte forma:

?
Por exemplo, a água destilada é uma substância pura, porque além de ser formada apenas por moléculas iguais de H2O, ela possui propriedades constantes. Ao nível do mar (sob pressão de 1 atm), seu ponto de fusão é igual a 0 ºC, seu ponto de ebulição é igual a 100 ºC e sua densidade é igual a 1,0 g/mL a 4ºC. Essas propriedades sempre são as mesmas para a água pura, independente da quantidade de amostra.
Existem dois tipos de substâncias puras: substâncias simples e substâncias compostas.

Por exemplo, o gás oxigênio é formado por moléculas de O2, isto é, somente por átomos do elemento oxigênio. Veja outros exemplos de substâncias simples a seguir:


Um exemplo é a própria água já mencionada, pois ela é formada por átomos de dois tipos de elementos, o hidrogênio e o oxigênio. Abaixo temos mais exemplos de substâncias compostas, também chamadas de compostos químicos:

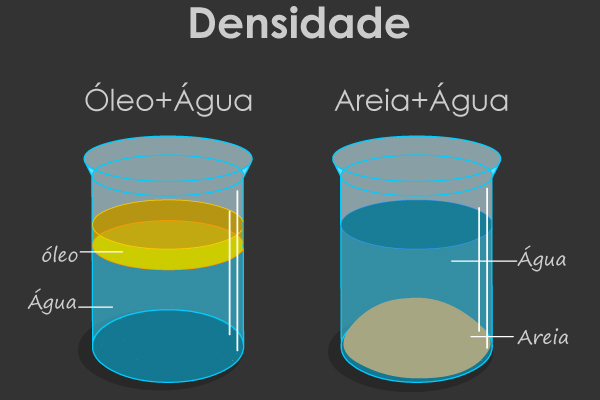
No entanto, a grande maioria dos materiais encontrados na natureza não é substância pura simples ou composta, mas sim mistura de substâncias. A água mineral, por exemplo, não é composta apenas por água (H2O), mas ela contém vários minerais dissolvidos, conforme se pode ver no rótulo de sua embalagem. A água do mar também é uma mistura de vários sais, principalmente o cloreto de sódio, mas com uma composição diferente da água mineral, da água de um rio, da água da torneira e assim por diante; sendo que, em todos os casos, temos misturas.
As misturas podem ser definidas da seguinte forma:

Existem misturas homogêneas e heterogêneas. Para saber mais, leia o texto abaixo:
Sistemas homogêneos e heterogêneos.
Aproveite para conferir nossas videoaulas sobre o assunto: