O texto Isomeria Óptica mostrou que, quando esse tipo de isomeria ocorre, significa que o composto desvia o plano de luz polarizada. Se após atravessar o composto orgânico, o plano de luz polarizada desviar-se para a direita (sentido horário), há o isômero dextrogiro. Mas se a luz polarizada vibrar em um plano à esquerda (sentido anti-horário), há o isômero levogiro.
Ambos, portanto, são opticamente ativos e são chamados de enantiômeros, antípodas ópticos ou enantimorfos, pois desviam a luz polarizada de um mesmo ângulo, mas em sentidos opostos.
Visto que esses desvios são contrários, se tivermos uma mistura com partes iguais de enantimorfos, um anulará a atividade óptica do outro, surgindo uma mistura denominada de racêmica, que é opticamente inativa por compensação externa.
A quantidade de misturas racêmicas pode ser determinada de acordo com a quantidade de carbonos assimétricos ou quirais presentes na molécula do isômero. Se há apenas um carbono assimétrico, é formada apenas uma mistura racêmica. Em casos em que há mais carbonos quirais diferentes, temos a seguinte regra: o número de misturas racêmicas é sempre a metade do número de estereoisômeros opticamente ativos.
Por exemplo, considere a estrutura da molécula de glicose mostrada a seguir:
OH OH OH H OH O
│ │ │ │ │ //
H ─ C ─ C* ─ C* ─ C* ─ C* ─ C
│ │ │ │ │ \
H H H OH H H
Os asteriscos indicam que a molécula possui quatro carbonos assimétricos diferentes. Portanto, apresenta 24=16 enantiômeros, sendo oito dextrogiros e oito levogiros. Assim, pode formar oito misturas racêmicas. Isso é bem explicado no texto Quantidade de Carbonos Assimétricos e Número de Isômeros Ópticos.
O nome “mistura racêmica” veio do latim racemus, que significa cacho de uva. Isso porque o cientista Louis Pasteur descobriu cristais de ácido tartárico produzidos na fermentação do suco de uva na produção do vinho. Ao estudá-los, ele viu que alguns desviavam o plano de luz para a direita, mas outros eram inativos, não provocando o desvio da luz polarizada. Isso acontecia porque, na verdade, esse segundo não era um isômero do ácido tartárico, mas, na verdade, uma mistura racêmica. Ele viu também que era possível a partir dessa mistura obter o isômero levogiro com o uso do lêvedo, pois ele só consome o isômero dextrogiro, deixando o levogiro.
No caso de moléculas que possuem mais de um carbono assimétrico ou quiral que são iguais, por ocorrer de um desses carbonos anular o desvio da luz polarizada do outro carbono, dando origem a uma composto meso, este é opticamente inativo por compensação interna.
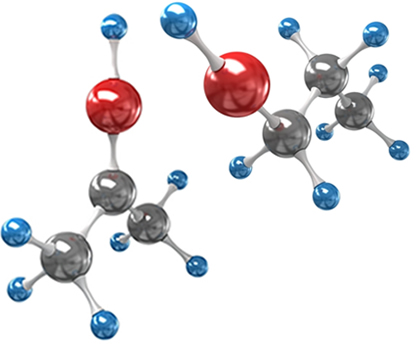
Por exemplo, considere o ácido tartárico:
OH OH
| |
HOOC ─ C* ─ C* ─ COOH
| |
H H
Visto que os carbonos assimétricos do ácido tartárico são iguais, eles provocarão um ângulo de desvio da luz polarizada de mesmo valor chamado genericamente de α. Resta saber qual é o sentido desses desvios. Assim, temos um isômero dextrogiro, um levogiro e um composto meso, pois um carbono assimétrico da molécula cancela o desvio causado no plano da luz polarizada pelo outro carbono assimétrico da molécula.