Os metais são elementos químicos que são maioria na Tabela Periódica. Como características químicas, costumam ter alto ponto de fusão, ebulição, além de condutividade elétrica no estado sólido, elevada densidade e baixa energia de ionização. Ao formarem compostos simples, apresentam um brilho característico, chamado de brilho metálico, além de serem dúcteis, maleáveis, com tenacidade e dureza variáveis.
Os metais são obtidos, na maioria das vezes, a partir de minérios, rochas cuja composição pode conter óxidos, sulfetos, fosfatos, entre outros elementos. Possuem ampla utilização na indústria e na sociedade, podendo formar ligas metálicas para a manufatura de diversos instrumentos e demais objetos, sendo sua exploração e processamento de grande interesse econômico.
Leia também: Titânio — elemento metálico amplamente utilizado na fabricação de ligas metálicas
Tópicos deste artigo
- 1 - Resumo sobre metais
- 2 - Videoaula sobre metais
- 3 - Características dos metais
- 4 - Tipos de metais
- 5 - Metais na Tabela Periódica
- 6 - Ligações químicas dos metais
- 7 - Obtenção dos metais
- 8 - Metais e ametais
- 9 - História dos metais
- 10 - Exercícios resolvidos sobre metais
Resumo sobre metais
-
A maioria dos elementos da Tabela Periódica são classificados como metais.
-
Possuem baixa energia de ionização e baixa eletronegatividade.
-
Suas substâncias têm brilho característico, além de possuírem boa condutividade elétrica e térmica no estado sólido.
-
Apresentam ductilidade e tenacidade, o que possibilita a fabricação de diversos objetos com boa resistência mecânica.
-
Suas substâncias se ligam por meio da ligação metálica.
-
Os metais são de grande importância econômica e têm sido essenciais para o desenvolvimento da humanidade.
Videoaula sobre metais
Características dos metais
Do ponto de vista atômico, a principal característica dos metais é a baixa energia de ionização, o que quer dizer que perdem os elétrons de valência com certa facilidade. As substâncias metálicas trazem outras propriedades marcantes, como a condutividade elétrica e térmica em estado sólido, o brilho característico, a elevada densidade e os altos pontos de fusão e ebulição.
Entre os metais, o tungstênio é o que possui maior ponto de fusão (3422 °C), o rênio é o que possui maior ponto de ebulição (5597 °C) e a prata é o de maior condutividade elétrica.

Claro que existem exceções. Por exemplo, o mercúrio é um metal que se apresenta líquido em temperatura e pressão ambientes, assim como o gálio, que possui um ponto de fusão na faixa dos 30 °C.

A ductilidade (capacidade de deformação) e a tenacidade (capacidade de resistir à ruptura) são características importantes dos metais, o que lhes permite estar presente na composição de diversos produtos, com formas e resistências variadas.
Os metais também são explorados na formação de ligas, misturas homogêneas entre substâncias metálicas. Assim, é possível criar misturas metálicas em que coexistam boas propriedades dos metais nelas inseridos.
Por exemplo, o ferro é o metal utilizado na confecção do aço, possuindo boa resistência mecânica, mas baixa resistência à corrosão. Metais como cromo e níquel podem ser adicionados na composição do aço, melhorando a resistência à corrosão, dando origem ao que conhecemos como aço inoxidável.
Tipos de metais
Os metais podem ser divididos em algumas classes específicas, sem necessariamente existir uma correlação entre elas.
-
Metais pesados: embora não haja uma definição formal do que é um metal pesado, a literatura clássica aponta que são metais de elevada densidade (valores maiores que 7 g/cm³, por exemplo). Atualmente, os livros atrelam o conceito de metais pesados às substâncias metálicas com potenciais de contaminação e toxicidade/ecotoxicidade. Embora existam diferenças entre os escritos dos autores, metais pesados clássicos e sempre citados são: chumbo, mercúrio, cádmio e antimônio.

-
Metais essenciais: são os metais necessários ao metabolismo humano, como cálcio, sódio, potássio, magnésio, ferro, zinco, cobre, estanho, vanádio, cromo, manganês, molibdênio, cobalto e níquel.
-
Metais nobres: são os metais de alto valor agregado, mas também com propriedades físico-químicas vantajosas, tais como elevados pontos de fusão e ebulição, boa condutividade elétrica, inércia química e também boa resistência à corrosão. São geralmente citados o ouro, a prata e os metais do grupo da platina: a própria platina, o paládio, o irídio, o ósmio, o ródio e o rutênio.

-
Metais alcalinos: são os metais que pertencem ao Grupo 1 da Tabela Periódica, tendo como principal característica uma violenta reação com a água. São o lítio, sódio, potássio, rubídio, césio e frâncio.
-
Metais alcalino-terrosos: são os metais que pertencem ao Grupo 2 da Tabela Periódica, ou seja, berílio, magnésio, cálcio, estrôncio, bário e rádio.
Leia também: Por que o ferro não se dissolve na água?
Metais na Tabela Periódica
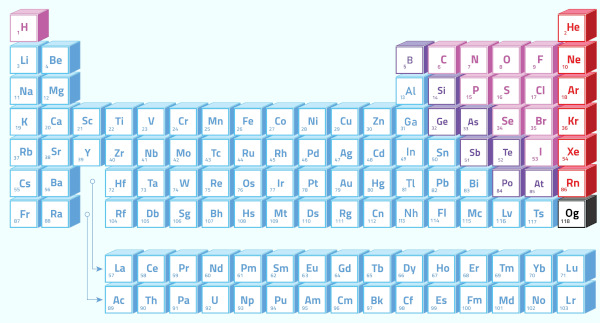
A maioria dos elementos da Tabela Periódica são metais, correspondendo a 87 elementos. Esse número poderia ser maior, contudo, elementos mais novos, por serem altamente instáveis, não possuem ainda estudos suficientes para caracterizá-los como metais ou não.
Os metais estão presentes em quase todos os Grupos da Tabela Periódica, do 1 ao 16, existindo então metais representativos e de transição, ou, em divisões mais atuais, metais nos blocos s, p, d e f da Tabela Periódica.
-
Videoaula sobre a tabela periódica
Ligações químicas dos metais
Os metais ligam-se quimicamente entre si por meio da chamada ligação metálica. A primeira tentativa de explicação da ligação metálica ocorreu em 1900, através dos trabalhos do físico alemão Paul Drude, que utilizava a Teoria Cinética dos Gases para explicar a condução elétrica e térmica dessas substâncias.
Em sua teoria, Drude afirmava que quando os átomos metálicos se unem para formar um metal, os elétrons de valência, fracamente ligados aos átomos metálicos por conta da baixa energia de ionização, desligam-se e passam a movimentar-se livremente por meio do metal. Os cátions metálicos gerados mantêm-se relativamente fixos, formando uma rede cristalina.
Assim, o metal é visualizado como um arranjo tridimensional regular de átomos, com uma grande quantidade de elétrons livres que podem se movimentar desimpedidamente por toda a extensão deste arranjo, como um gás.
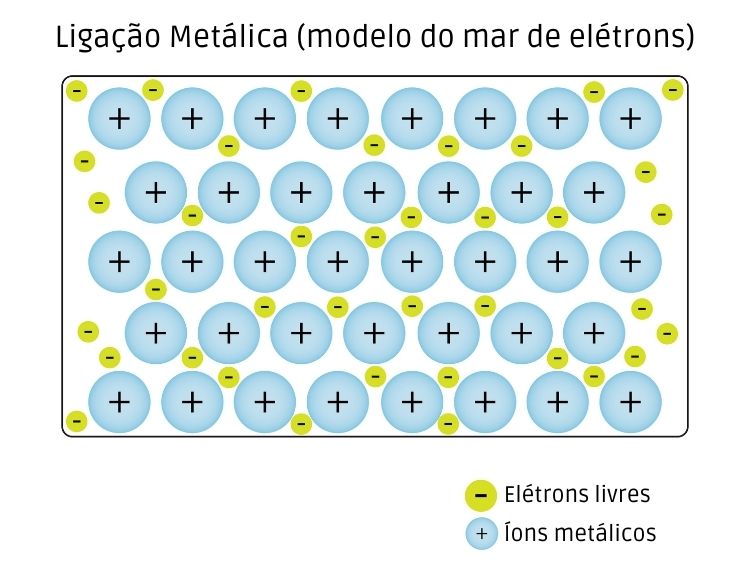
O modelo desenvolvido através da teoria de Drude é o que conhecemos hoje comumente por “mar de elétrons”, um modelo de ligação metálica muito razoável para explicar a condutividade térmica e elétrica dos metais em fase sólida. Contudo, o modelo é obsoleto, pois esbarra em uma série de limitações da mecânica estatística clássica, quando na verdade são necessários modelos derivados da mecânica quântica para explicar o comportamento dos elétrons na estrutura metálica.
Hoje, a ligação metálica é melhor explicada através de um conceito de Ensino Superior: a Teoria do Orbital Molecular. Mesmo assim, é inegável que os trabalhos de Drude foram essenciais para propulsionar estudos na área da estrutura metálica.
Obtenção dos metais
Quase todos os metais são encontrados na natureza na forma de minérios, que são substâncias compostas entre o metal e outros elementos químicos, como oxigênio, enxofre e fósforo, por exemplo. Apenas os metais nobres são encontrados em forma pura (nativa), uma vez que estes são quimicamente inertes e não reagem para a formação de substâncias compostas.

A exploração e obtenção dos metais têm grande importância para a economia dos países. Em 2019, por exemplo, o Brasil lucrou cerca de 48,6 bilhões de dólares com a exportação de produtos metálicos básicos (como minérios).

O ramo que estuda técnicas para extração, refino e processamento de metais é chamado de metalurgia. Há também a siderurgia, que, na verdade, é a metalurgia aplicada ao ferro, uma vez que este metal é o de maior produção e exploração mundial. Entre as técnicas principais da metalurgia para o processamento dos minérios estão a hidrometalurgia, a qual trabalha com técnicas de lixiviação (lavagem ácida ou básica), e a pirometalurgia (tratamento sob altas temperaturas).

Para a obtenção dos metais na forma pura, as principais técnicas utilizadas são os processos eletroquímicos, como a eletrólise e a eletrodeposição, além da utilização de resinas de troca iônica.
Leia também: Produção de alumínio por eletrólise — fruto da mistura entre alumina e criolita
Metais e ametais
Atualmente, a divisão entre elementos é binária: ou o elemento é um metal ou não é. Caso não seja, se trata de um ametal.
Os metais e ametais possuem características opostas. Enquanto os metais possuem baixa energia de ionização, baixa eletronegatividade, boa condutividade elétrica e térmica em temperatura ambiente, brilho característico, além de serem dúcteis e maleáveis, os ametais são justamente o contrário, com alta afinidade eletrônica, alta eletronegatividade, sem o brilho característico e as outras propriedades.
Até certo tempo, existia a definição de semimetais, que seriam elementos com propriedades intermediárias entre os metais e ametais, como o fato de serem semicondutores elétricos (isolantes em baixa temperatura e condutores em alta temperatura) e possuírem eletronegatividade intermediária. Entretanto, deve-se dizer que a utilização do termo semimetal está em desuso e tal terminologia não é mais empregada na maior parte da literatura química.
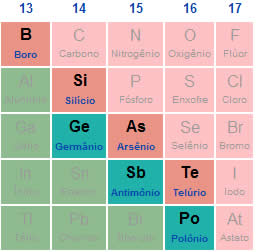
Atualmente, a tendência é dividir esses elementos em metais ou ametais. A Sociedade Brasileira de Química (SBQ), em sua Tabela Periódica, classifica boro, silício, arsênio e telúrio como ametais, enquanto germânio, antimônio e polônio são considerados metais.
História dos metais
Os metais estão intimamente ligados à história do desenvolvimento de nossa sociedade. É por conta disso que os historiadores definem a Idade dos Metais, que marcou o fim da Idade da Pedra, ocorrendo a partir de 3500–3300 a.C., como a Era do Cobre.
Nesse período, os seres humanos, já sabendo manipular e controlar o fogo, começaram a desenvolver técnicas de fundição para o manejo de metais como cobre, estanho e ferro, a fim de criar utensílios e armas, iniciando-se a metalurgia. Da manipulação do cobre e estanho, adveio o bronze, iniciando a chamada Era do Bronze.

Outro ponto importante na história dos metais foi o desenvolvimento do aço, ocorrido em 1856 por causa do engenheiro metalúrgico inglês Henry Bessemer, que descobriu uma forma de diminuir o teor de carbono presente no ferro. O aço é a liga metálica mais utilizada no mundo e seu desenvolvimento e produção foram fundamentais para o desenvolvimento humano.
Exercícios resolvidos sobre metais
Questão 1
(UERJ 2020) Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”. “Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
A) Iônica
B) Metálica
C) Covalente
D) De hidrogênio
Resposta:
A ligação interatômica (química) faz referência ao modelo desenvolvido por Paul Drude para explicar os elétrons em uma estrutura metálica. Sendo assim, “mar de elétrons” se refere à ligação metálica, sendo o gabarito o de letra B.
Questão 2
(UERJ 2017) O rompimento da barragem de contenção de uma mineradora em Mariana (MG) acarretou o derramamento de lama contendo resíduos poluentes no rio Doce. Esses resíduos foram gerados na obtenção de um minério composto pelo metal de menor raio atômico do grupo 8 da tabela de classificação periódica. A lama levou 16 dias para atingir o mar, situado a 600 km do local do acidente, deixando um rastro de destruição nesse percurso. Caso alcance o arquipélago de Abrolhos, os recifes de coral dessa região ficarão ameaçados.
O metal que apresenta as características químicas descritas no texto é denominado:
A) Ferro
B) Zinco
C) Sódio
D) Níquel
Resposta:
No Grupo 8 da Tabela Periódica, constam os seguintes metais: ferro, rutênio, ósmio e hássio. Isso já serviria para marcação da alternativa A, pois os demais metais não pertencem ao Grupo 8. Contudo, caso houvessem outros metais, o ferro seria também o de menor raio atômico, pois é o que possui o menor número de camadas eletrônicas.