Segundo a regra do octeto, para que um átomo adquira estabilidade, ele precisa possuir oito elétrons na camada de valência (camada mais externa ao núcleo), e apenas dois elétrons nos casos de átomos que possuem apenas a camada K; ou seja, com a configuração de gás nobre.
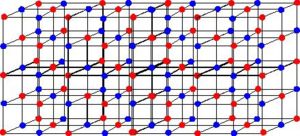
Assim, consideremos a ligação feita entre os átomos de sódio (Na) e cloro (Cl), para a formação do cloreto de sódio (NaCl), ou seja, o sal de cozinha: no seu estado neutro, o átomo de sódio possui 1 elétron em sua camada de valência. Portanto, ele precisa perder este elétron para ficar com oito na sua última camada e assim se tornar estável. Já o átomo de cloro possui sete elétrons na sua camada de valência, necessitando receber um elétron para ficar estável. Assim, o átomo de sódio doa um elétron para o átomo de cloro. Desse modo, temos um íon positivo (cátion sódio (Na+)) e um íon negativo (ânion cloreto (Cl-)), ambos com o octeto completo.

Neste caso, dizemos então que ocorreu uma ligação iônica. Portanto,
Ligação Iônica é a única em que ocorre transferência definitiva de elétrons.
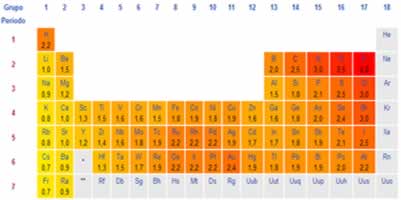
Assim, este tipo de ligação ocorre entre aqueles átomos que têm tendências opostas, ou seja, um tem a tendência de receber elétrons (na maioria das vezes são os ametais das famílias 15, 16 e 17 e também o hidrogênio) e o outro de doar elétrons (na maioria das vezes são os metais das famílias 1, 2 e 3).
Aproveite para conferir nossa videoaula sobre o assunto: