A isomeria geométrica E-Z foi proposta pelos cientistas Chritopher Kelk Ingold (químico inglês) e Vlasdimir Prelog (químico bósnio) para solucionar casos de isomeria que apresentam as seguintes características:
a) Para cadeia aberta
-
Cadeia aberta com uma ligação dupla;
-
Os ligantes de um carbono da dupla são total ou parcialmente diferentes dos ligantes do outro carbono da dupla.

Fórmula estrutural do 3-metilpent-2-eno
b) Para cadeia fechada
-
Cadeia fechada saturada (apenas ligações simples entre os carbonos);
-
Dois carbonos da cadeia apresentam ligantes total ou parcialmente diferentes entre si.

Fórmula estrutural do 1- bromo-1-etil-2-metil-ciclopentano
Casos rotineiros de isomeria geométrica E-Z
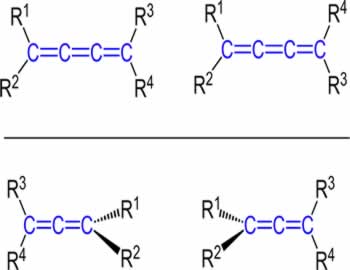
Na isomeria geométrica E-Z, são estudadas as posições ocupadas pelos ligantes dos carbonos da ligação dupla levando-se em consideração o número atômico ou a complexidade de cada um deles, como nos exemplos a seguir:
Exemplo 1: Caso estejamos comparando dois ligantes simples, como cloro (cujo número atômico é 17) e hidrogênio (cujo número atômico é 1), o cloro será levado em consideração por apresentar maior número atômico.
Exemplo 2: Caso o ligante tenha dois elementos, sempre levaremos em consideração aquele que apresenta o maior número atômico. No caso do metil (CH3), temos carbono com número atômico igual a 6 e os hidrogênios com número atômico igual 1, assim, levamos em consideração o carbono.
Exemplo 3: Caso o ligante tenha dois ou mais grupos, sempre o levamos em consideração por apresentar uma maior complexidade. Se compararmos os radicais etil (H3C-CH2) e metil (CH3), o etil será levado em consideração por apresentar uma maior complexidade.
Significado das siglas E-Z da isomeria geométrica E-Z
Na isomeria geométrica E-Z, avaliamos os ligantes em um mesmo plano (superior ou inferior) da molécula, assim como na isomeria geométrica cis-trans. Em uma estrutura aberta, o plano passa sempre entre os carbonos da dupla.

Em uma estrutura fechada, o plano passa entre os carbonos que apresentam ligantes diferentes.

-
Isômero E: A sigla E vem do alemão Entgegen, que significa opostos. Nesse tipo de isômero geométrico, teremos os dois ligantes de maior complexidade de cada carbono da dupla em planos opostos.

Fórmula estrutural de um isômero E
-
Isômero Z: A sigla Z vem do alemão Zusammen, que significa opostos. Nesse tipo de isômero geométrico, teremos os dois ligantes de maior complexidade de cada carbono da dupla em planos opostos.

Fórmula estrutural de um isômero Z
Exemplos de aplicação da isomeria geométrica E-Z
→ 3-metil-hex-2-eno

Fórmula estrutural do 3-metil-hex-2-eno
Nesse alceno, no carbono 2, temos o ligante hidrogênio (H) e metil (CH3), sendo o metil o mais complexo. No carbono 3, temos o ligante metil e o propil (H3C-CH2-CH2), sendo o propil o mais complexo. Veja os seus isômeros E e Z:

Fórmula estrutural do isômero Z-3-metil-hex-2-eno
Temos nessa estrutura o ligante propil (mais complexo) de um carbono da dupla no plano inferior e o ligante metil (mais complexo) do outro carbono da dupla também no plano inferior, ou seja, no mesmo plano. Por essa razão, temos um isômero Z.

Fórmula estrutural do isômero E-3-metil-hex-2-eno
Temos nessa estrutura o ligante propil (mais complexo) de um carbono da dupla no plano inferior e o ligante metil (mais complexo) do outro carbono da dupla no plano superior, ou seja, em planos opostos. Por essa razão, temos um isômero E.