A isomeria espacial, também denominada de estereoisomeria, considera a disposição no espaço dos átomos que formam as moléculas da substância.
Existem dois tipos de isomeria espacial, a isomeria geométrica e a isomeria óptica. Consideremos, portanto, como se dá a isomeria geométrica cis-trans e a E-Z:
1. Isomeria geométrica cis-trans:
 ..
..
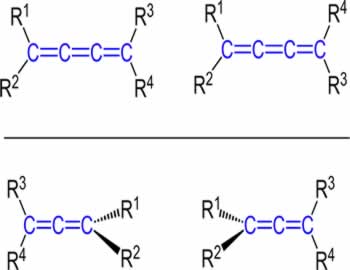
Esse tipo de isomeria ocorre em compostos alifáticos que apresentam pelo menos uma dupla ligação entre carbonos, e cada um dos carbonos da dupla apresentam ligantes diferentes, segundo o esquema geral abaixo:
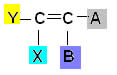
Onde Y e X têm que ser obrigatoriamente diferentes; e o mesmo se aplica para A e B.
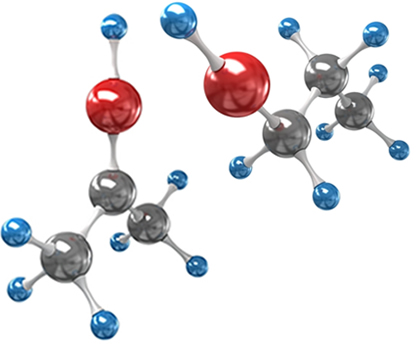
Considere como exemplo o composto formado quando se substitui dois hidrogênios, um de cada carbono do eteno, por átomos de cloro. São obtidas duas estruturas diferentes, porém com a mesma fórmula molecular:
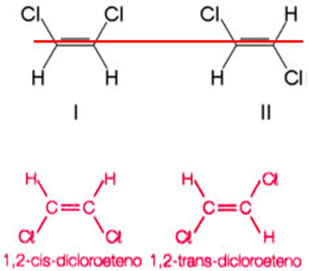
O eixo da dupla ligação permite que haja uma rotação no 1,2- dicloroeteno. Assim, note que se traçarmos um plano imaginário nesse eixo será possível ver a formação de produtos com conformações diferentes, ou seja, com construções espaciais distintas. De modo que, no caso, temos o cis-1,2-dicoroeteno e o trans-1,2-dicloroeteno.
É possível também ter esse tipo de isomeria em compostos cíclicos, ou seja, de cadeia fechada, desde que apresentem grupos ligantes diferentes em pelo menos dois carbonos do ciclo, de acordo com o esquema:
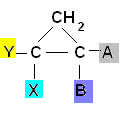
Um exemplo é o 1,2-diclorociclopropano que, segundo a mesma regra dos alifáticos, será denominado cis se os radicais iguais estiverem do mesmo lado do plano; e trans se estiverem em lados opostos:
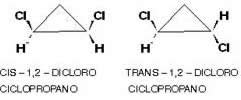
2. Isomeria geométrica E-Z:
Em determinados alcenos, os ligantes dos carbonos participantes da ligação dupla são todos diferentes entre si. Nesses caso, não é possível realizar a denominação cis-trans.
Desse modo, criou-se a denominação E-Z, onde “E” vem da palavra alemã entgegen, que significa opostos; e “Z”, da palavra alemã zusammen (juntos).
Nesse sistema, examinamos os ligantes dos carbonos da dupla e em cada um determinamos qual é o ligante que tem mair número atômico.
Assim, teremos:

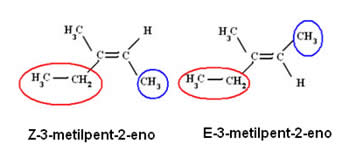
No exemplo abaixo, os ligantes de maior número atômico estão circulados e os seus respectivos nomes são dados: