O hidróxido de sódio é a base inorgânica hidróxido de sódio, cuja fórmula molecular é dada por NaOH. É um sólido branco à temperatura ambiente, pois seu ponto de fusão é 318 ºC, porém visto que absorve a umidade do ar (é higroscópico), transforma-se após certo tempo em um líquido incolor.
Comercialmente é conhecido como soda cáustica, que é muito usada para limpezas pesadas. Ela recebe esse nome porque é corrosiva, sendo muito perigosa para os tecidos animais. Quando uma pessoa utiliza este produto para qualquer finalidade, é imprescindível o uso de luvas, pois o seu contato com a pele causa severas queimaduras.
O hidróxido de sódio é uma base bastante solúvel em água, sofrendo dissociação iônica e liberando os íons Na+ e OH-.
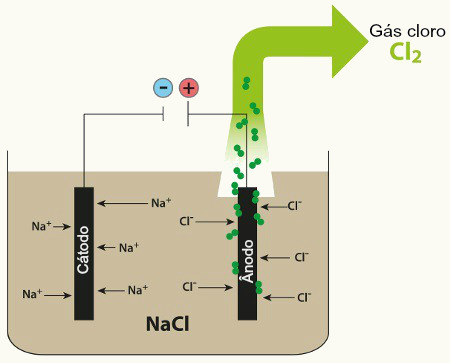
Esse produto não é encontrado na natureza, sendo produzido em laboratório por meio de um processo chamado eletrólise aquosa do cloreto de sódio (NaCl), isto é, eletrólise da salmoura. Nesse processo é passada uma corrente elétrica pela salmoura, que possui os seguintes íons dissolvidos:
NaCl → Na+ + Cl-
H2O → H+ + OH-
Entre esses íons os que têm maior facilidade de descarga são o H+ e o Cl-. Assim, o cátion Na+ e o ânion OH- permanecerão na solução formando uma solução de hidróxido de sódio. Além disso, o H+ e o Cl- irão reagir e o gás cloro (Cl2) e o gás hidrogênio (H2) serão produzidos:

Essa solução de hidróxido de sódio deve ser guardada em um recipiente de plástico, porque o NaOH reage pouco a pouco com o vidro.
Ele possui a capacidade de reagir também com óleos e gorduras, em uma reação de saponificação (ou hidrólise alcalina) que leva à formação do sabão. De forma genérica, essa reação envolve o aquecimento do hidróxido de sódio com óleos ou gorduras, produzindo sabão e glicerina:
Óleo ou gordura + base (NaOH) → sabão + glicerina
Exemplo de uma reação de saponificação:
.jpg)
Outras aplicações do hidróxido de sódio são:
-
Purificação de derivados de petróleo e de óleos vegetais;
-
Fabricação de produtos de uso doméstico (como desentupidores de pias e ralos e na remoção de sujeiras pesadas);
-
Preparação de produtos orgânicos, tais como papel, celofane, seda artificial, celulose e corantes.