No texto Introdução às funções inorgânicas foi mostrado que as substâncias inorgânicas são divididas em quatro grupos ou funções, que são: ácidos, bases, sais e óxidos. No entanto, os conceitos que definem essas funções inorgânicas baseiam-se na teoria da dissociação iônica de Arrhenius, que classifica essas substâncias (com exceção dos óxidos) de acordo com os íons liberados em meio aquoso.
No entanto, quando algumas dessas substâncias inorgânicas não estão no meio aquoso, elas apresentam algumas características diferenciadas que não as colocam em nenhuma dessas funções. Por exemplo, o gás sulfeto de hidrogênio (H2S), em meio aquoso, libera cátions H+, formando o ácido sulfídrico. Mas quando ele está no estado original gasoso e ainda é um composto molecular sem íons, em qual grupo ele se encaixa, tendo em vista que suas propriedades ficam diferentes do ácido que ele forma?
Bem, por essa razão, surgiu um quinto grupo que quase não é estudado no ensino médio, trata-se dos hidretos.
Os hidretos são compostos inorgânicos formados somente por dois tipos de elementos químicos, e um deles é obrigatoriamente o hidrogênio.
Os hidretos podem dividir-se em hidretos iônicos e moleculares. No caso do gás sulfeto de hidrogênio, ele é um hidreto molecular, pois é formado por ligações covalentes (ou moleculares em que se compartilham pares de elétrons) do hidrogênio com um ametal (pode ser com um semimetal também).
No caso dos hidretos moleculares, o hidrogênio possui carga +1. Outros exemplos são: HF, CH4, H2O e NH3.
Já os hidretos iônicos são formados quando ocorre uma ligação iônica entre o hidrogênio e um metal, e a carga do hidrogênio fica igual a -1. Esses hidretos apresentam-se nas condições ambientes com estrutura sólida cristalina e altos pontos de fusão, reagindo violentamente com água e originando soluções básicas.
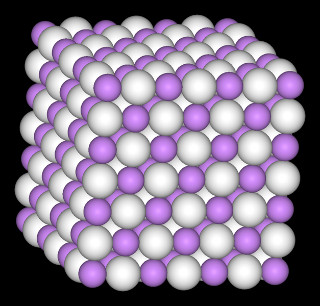
Um exemplo é o hidreto de lítio (LiH), cuja estrutura foi ilustrada no início deste artigo. Quando esse sólido é adicionado à água, os cátions Li+ formados unem-se aos ânions OH- da água e originam a base hidróxido de lítio (LiOH).
Além disso, o ânion H- do hidreto reage com o cátion H+ da água, formando o gás hidrogênio, H2. A produção de gás hidrogênio é, inclusive, a principal aplicação dos hidretos iônicos. Por exemplo, em botes salva-vidas existem hidretos, de modo que, quando os botes caem na água, forma-se o gás hidrogênio que os infla.
Outros exemplos de hidretos iônicos são: NaH e CaH2.
Videoaula relacionada: