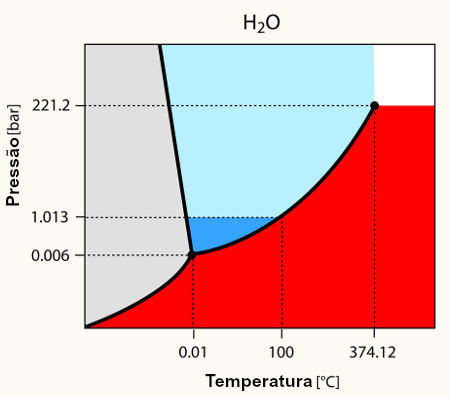
Quando ocorre a mudança de estado físico das substâncias puras, a temperatura permanece constante até que toda a substância tenha mudado totalmente de estado físico.
Por exemplo, a água passa do estado sólido (gelo) para o estado líquido a 0ºC ao nível do mar. Essa temperatura corresponde ao ponto de fusão (ou de solidificação) da água, que permanecerá em 0ºC até que todo o gelo derreta. Lembre-se de que o ponto de fusão e o ponto de solidificação são iguais, o que muda é se a substância está sendo aquecida e passando de sólido para líquido, ou se está sendo resfriada e ocorrendo o oposto.
A temperatura também permanece constante quando a água passa do estado líquido para o gasoso, que é em 100ºC, ao nível do mar. Esse é o valor do ponto de ebulição ou de condensação da água.
Visto que a temperatura permanece constante nesses dois pontos de mudança de estado físico, temos que o gráfico que representa as mudanças de estado físico da água irá conter dois patamares. Observe:

Conforme dito no início, isso acontece com todas as substâncias puras e por isso o gráfico de mudança de estado físico de todas elas apresentam também dois patamares.
No entanto, se aquecermos ou resfriarmos uma mistura, veremos que a mesma situação não ocorre, a temperatura não permanece constante nessas faixas de mudança de estado físico, mas vai mudando gradualmente.
Por exemplo, uma mistura de água e sal colocada no congelador começa a se solidificar em 0ºC sob pressão de 1atm; porém, não permanece em 0ºC, mas apresenta uma faixa de temperaturas de solidificação. Isso também ocorre quando aquecemos essa mistura, ela começa a ferver acima de 100ºC, mas não permanece constante durante a ebulição. Além disso, esses valores variam dependendo da quantidade de sal e de água que foram misturados.
Dessa forma, temos que o gráfico de mudança de estado físico da salmoura não apresenta nenhum patamar, isso também vale para outras misturas.

Existem dois tipos de misturas especiais que são exceções a essa regra, veja quais são lendo o texto “Misturas Eutéticas e Azeotrópicas”.
Aproveite para conferir nossa videoaula sobre o assunto: