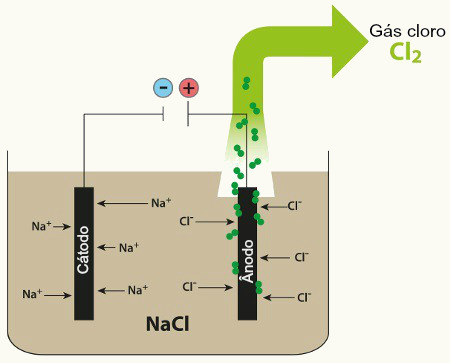
Algumas fórmulas podem ser utilizadas como importantes recursos matemáticos para determinar aspectos relacionados a uma eletrólise, seja ela ígnea, seja em meio aquoso, como:
-
Tempo de ocorrência da eletrólise: o tempo em que uma descarga elétrica incidirá sobre um sistema em eletrólise depende exclusivamente da massa que será depositada;
-
Massa depositada no cátodo durante a eletrólise: em uma eletrólise, ocorre a deposição de uma massa metálica sobre o cátodo. Essa massa depende totalmente do tempo de duração da eletrólise.
-
NOX do metal utilizado na eletrólise: o metal utilizado em uma eletrólise apresenta-se em forma de cátion, seja por causa da fusão sofrida pelo material, seja pela dissociação durante a dissolução em água. Porém, independentemente da origem, o cátion apresenta uma carga referente ao número de elétrons perdidos pelo metal.
A seguir, conheça as fórmulas para cálculos relacionados à eletrólise e as situações em que são rotineiramente aplicadas.
Fórmulas para cálculos relacionados a qualquer tipo de eletrólise
Nos cálculos envolvendo a eletrólise, é frequentemente usado o equivalente-grama (E) do metal utilizado na eletrólise. Para calcular o equivalente-grama, é aplicada a seguinte a fórmula:
E = M
k
-
M = massa molar do metal depositado na eletrólise;
-
k = é o NOX do metal depositado na eletrólise.
Fórmula para determinar a massa depositada no cátodo
Para determinar a massa que será depositada no cátodo de uma eletrólise ígnea ou aquosa, podemos utilizar as seguintes fórmulas:
-
Quando são fornecidos a carga utilizada na eletrólise e os meios para determinar o equivalente-grama:
m = Q.E
F
Obs.: Um faraday equivale a 96500 C, assim, podemos substituir F por esse valor.
m = Q.E
96500
-
Quando são fornecidos a corrente (i) utilizada, o tempo (t) de duração e o equivalente-grama (E) do metal da eletrólise:
m = i.t.E
96500
Obs.: A fórmula utiliza o conceito de carga (Q), que é o produto da corrente (i) pelo tempo (t).
Fórmulas para cálculo relacionado à eletrólise em série
Na eletrólise em série, existem duas ou mais cubas eletrolíticas conectadas por fios elétricos (como na representação a seguir) e em cada cuba há um sal diferente.
.jpg)
Representação de uma eletrólise em série
Como nesse tipo de eletrólise a carga que passa por cada uma das cubas é a mesma, podemos utilizar a seguinte relação:
m1 = m2 = m3
E1 E2 E3
Exemplos de aplicação das fórmulas relacionadas à eletrólise
1º Exemplo - (Unicap-PE) Determinar a valência de um metal com base nas seguintes informações: a eletrólise, durante 150 minutos, com uma corrente de 0,15 A de uma solução salina do metal, cuja massa atômica é 112 u, depositou 0,783 g desse metal.
Dado: faraday = 96.500 C
-
Tempo (t): 150 minutos ou 9000 segundos (depois de multiplicar por 60)
-
Corrente (i): 0,15 A
-
Massa atômica do metal (M): 112 u
-
Massa depositada (m): 0,783 g
-
NOX do metal: ?
Para determinar o NOX do metal, basta fazer os seguintes passos:
1º Passo: Utilizar os valores fornecidos pelo exercício na equação a seguir para determinar o equivalente-grama:
m = i.t.E
96500
0,783 = 0,15.9000.E
96500
0,15.9000.E = 0,783.96500
1350.E = 75559,5
E = 75559,5
1350
E = 55,97
2º Passo: Utilizar o dado obtido na seguinte fórmula:
E = M
k
55,97 = 112
k
k = 112
55,97
k = +2
2º Exemplo - (UFSC) A massa atômica de um elemento é 119 u. O número de oxidação desse elemento é + 4. Qual a massa depositada desse elemento quando se fornecem na eletrólise 9.650 Coulomb?
Dado: 1 faraday = 96.500 C
a) 11,9 g
b) 9650 × 119 g
c) 1,19 g
d) 2,975 g
-
m = ?
-
Massa atômica do metal (M): 119 u
-
Carga utilizada (Q): 9650 C
-
NOX do metal: +4
Para determinar a massa depositada do metal, basta fazer os seguintes passos:
1º Passo: Utilizar a fórmula para calcular o equivalente-grama:
E = M
k
E = 119
4
E = 29,75
2º Passo: Utilizar o valor obtido anteriormente na seguinte equação para determinar a massa depositada do metal:
m = Q.E
96500
m = 9650.29,75
96500
m = 287087,5
96500
m = 2,975g
3º Exemplo - (ITA-SP) Uma fonte de corrente contínua fornece corrente elétrica a um sistema composto por duas células eletrolíticas, ligadas em série por meio de um fio condutor. Cada célula é dotada de eletrodos inertes. Uma das células contém somente uma solução aquosa 0,3 molar de NiSO4 e a outra apenas uma solução aquosa 0,2 molar de Au(Cl)3. Se durante todo o período da eletrólise as únicas reações que ocorrem nos cátodos são as deposições dos metais, qual das opções corresponde ao valor da relação: massa de níquel/massa de ouro depositado?
a) 0,19
b) 0,45
c) 1,0
d) 2,2
e) 5,0
-
Molaridade do NiSO4: 0,3 molar
-
Molaridade do Au(Cl)3 : 0,3 molar
Para determinar a relação entre a massa de níquel e a massa de ouro, é fundamental fazer os seguintes passos:
1º Passo: Determinar o NOX do Ni.
Na fórmula do sal (NiSO4) – composto iônico, ou seja, apresenta um cátion e um ânion –, o índice 1 está presente no Ni e no SO4, o que indica que a carga do cátion e do ânion são iguais em número.
Nesse caso, a carga do cátion é determinada pela carga do ânion. Como o ânion SO4 tem carga -2, logo, o cátion apresenta NOX +2.
2º Passo: Determinar o NOX do Au.
Na fórmula do sal Au(Cl)3, que é um composto iônico, o índice 1 está presente no Au, e o índice 3, no Cl. Como em um composto iônico os índices provêm do cruzamento de cargas entre os íons, logo, o NOX do u é +3.
3º Passo: Calcular o equivalente-grama do Ni.
E = M
k
E = 58
2
E = 29
4º Passo: Determinar o equivalente-grama do Au.
E = M
k
E = 197
3
E = 65,6
5º Passo: Determinar a relação entre a massa de níquel e a massa de ouro:
mNi = mAu
ENi EAu
mNi = mAu
29 65,6
65,6. mNi = 29. mAu
mNi = 29
mAu 63,5
mNi = 0,45 (aproximadamente)
mAu