No cotidiano, notamos que em temperatura ambiente algumas substâncias estão no estado sólido, outras no líquido e outras no gasoso. De um estado físico para o outro o que muda é a força de interação entre as partículas.
Por exemplo, as partículas no estado sólido estão bem próximas, com pouca liberdade de movimento, o que significa que a força de atração entre suas moléculas ou força intermolecular é bem grande.
E quanto maior for essa força, maior será a energia necessária para rompê-la e mudar o estado físico do material.
Mesmo entre materiais que estão no mesmo estado físico, nota-se que existem diferentes forças intermoleculares. Um exemplo é se despejarmos três gotas de acetona e três gotas de água em colheres separadas e observarmos o que ocorre. Veremos que a acetona evaporará bem mais rápido que a água, o que significa que suas forças intermoleculares são mais fracas.
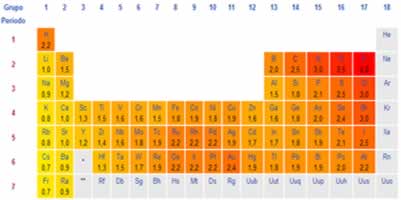
O físico holandês Johannes Van der Waals estudou e propôs a existência dessas forças, em 1873. Por isso, elas passaram a ser chamadas de Forças de Van der Waals. Apenas as forças intermoleculares existentes entre moléculas apolares foram explicadas por outro cientista: Fritz London.
As três forças intermoleculares são:
1. Forças dipolo induzido-dipolo induzido (também chamada de forças ou ligações de Van der Waals ou forças de dispersão de London):
Acontece em moléculas apolares. Num dado instante, os elétrons de uma molécula apolar, que estão em constante movimento, passam a ter mais elétrons de um lado do que de outro, ficando esta, assim, momentaneamente polarizada. Desse modo, por indução elétrica, ela irá polarizar uma molécula vizinha, ou seja, vai criar um dipolo induzido. Veja abaixo o exemplo da molécula apolar do iodo (I2):

Isso pode ocorrer não só em razão dos movimentos dos elétrons, mas também pela colisão das moléculas. Esta é a mais fraca de todas as ligações intermoleculares.
2. Forças dipolo permanente-dipolo permanente ou dipolo-dipolo:
Ocorre em moléculas polares, em que uma extremidade é positiva e a outra negativa, criando um dipolo elétrico permanente, como mostrado abaixo, no caso das moléculas de HCl, em que a parte positiva atrai a parte negativa da molécula vizinha, e assim por diante:

.
3. Ligação de Hidrogênio:
Ocorre quando o hidrogênio de uma molécula liga-se a outros átomos pequenos e fortemente eletronegativos, principalmente flúor, oxigênio e nitrogênio. Um exemplo é a água: o hidrogênio (com carga parcialmente positiva) de uma molécula é atraído pelo oxigênio (carga parcialmente negativa) de outra molécula vizinha:

Essa é a mais forte de todas as forças intermoleculares. Desse modo, temos:
| Ordem crescente de intensidade de interação: |
| dipolo induzido-dipolo induzido < dipolo-dipolo < ligação de hidrogênio |
Aproveite para conferir nossas videoaulas sobre o assunto: