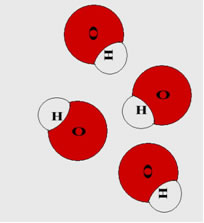
A força das bases é um dos critérios utilizados para classificar as substâncias que fazem parte dessa importante função inorgânica. Outros critérios são a solubilidade e a quantidade de grupos OH.
Em especial, a força das bases é uma forma de classificação que estuda a capacidade da base em liberar íons, na forma de cátions e ânions, ao sofrer o fenômeno da dissociação, quando dissolvida em água ou ao sofrer fusão.
Representação da equação de dissociação de uma base.
Com relação à força, as bases podem ser classificadas em:
-
Bases fracas: são aquelas que liberam poucos íons quando estão dissolvidas em água ou fundidas.
-
Bases fortes: são aquelas que liberam muitos íons quando estão dissolvidas em água ou fundidas.
A seguir, tratamos das formas como podemos prever ou determinar a força das bases:
Determinação da força das bases por meio da nomenclatura
A nomenclatura de uma base segue o padrão abaixo:
Hidróxido + de + nome do elemento
Obs.: O cátion amônio (NH4+) pode fazer parte da composição de uma base, não sendo, portanto, um elemento, e sim um cátion composto.
A realização da classificação das bases quanto à força, utilizando o nome da base, adota o seguinte padrão:
- Base forte = quando no nome da base há a presença do nome de um metal alcalino (família IA) ou metal alcalinoterroso (família IIA).
- Obs.: Mesmo sendo um metal alcalinoterroso, o elemento magnésio (Mg) forma base fraca.
- Base fraca = quando no nome da base aparece o nome de qualquer metal ou do cátion amônio (NH4+).
1º Exemplo: Hidróxido de potássio
Como o elemento potássio faz parte da família IA, o hidróxido de potássio é uma base forte.
2º Exemplo: Hidróxido de ferro III
Como o elemento ferro faz parte da família VIIIB, o hidróxido de ferro III é uma base fraca.
Determinação da força das bases por meio da fórmula química
A fórmula de uma base apresenta como padrão o grupo OH ligado a um metal qualquer ou ao cátion amônio (NH4+):
YOH ou NH4OH
Quando se tem conhecimento da fórmula da base, para realizar a classificação quanto à força, basta verificar se o elemento químico que acompanha o grupo hidroxila obedece os seguintes padrões:
- Bases fortes: são aquelas que apresentam metais alcalinos (família IA) e alcalinoterrosos (família IIA).
- Obs.: Como já foi mencionado, mesmo sendo um metal alcalinoterroso, o elemento magnésio (Mg) forma base fraca.
- Bases fracas: são aquelas que apresentam qualquer outro metal ou o cátion amônio (NH4+).
1º Exemplo: Ca(OH)2
Como o elemento cálcio (Ca) faz parte da família IIA, o hidróxido de cálcio é uma base forte.
2º Exemplo: Cu(OH)2
Como o elemento cobre faz parte da família IB, o hidróxido de cobre II é uma base fraca.
Determinação da força das bases pelo grau de dissociação iônico
O grau de ionização é uma variável matemática cuja unidade é a porcentagem (%), que indica a quantidade de íons liberados pela base durante a dissociação, ao ser adicionada à água.
Para realizar o cálculo do grau de ionização, basta dividir a quantidade de partículas dissociadas pelo número de partículas dissolvidas, como na seguinte expressão:
α = no de partículas dissociadas
no de partículas dissolvidas
Obs.: O resultado encontrado pela expressão acima deve ser multiplicado por 100 para, assim, resultar na porcentagem.
A partir do conhecimento do grau de dissociação, pode-se determinar a força das bases utilizando os seguintes parâmetros:
- Bases fracas = possuem um grau de dissociação menor que 5%.
α < 5%
- Bases fortes = possuem um grau de dissociação maior ou igual a 5%.
α ≥ 5%
Exemplo: Sessenta partículas de uma determinada base foram adicionadas à água. Após certo tempo, 35 delas foram dissociadas. Qual o grau de dissociação dessa base?
α = no de partículas dissociadas
no de partículas dissolvidas
α = 35
60
α = 0,58 aproximadamente, ou 58%
Como a porcentagem é maior que 5%, trata-se de uma base forte.
Videoaula relacionada:


.jpg)