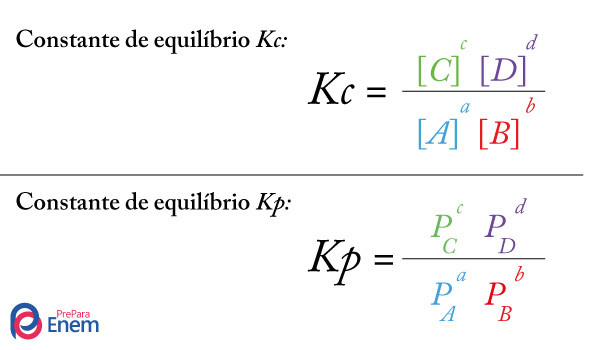Uma reação reversível é aquela que se processa tanto no sentido direto, de formação dos produtos, quanto no sentido inverso, de formação dos reagentes. Assim, as reações reversíveis processam-se simultaneamente nos dois sentidos.
Quando a taxa de desenvolvimento ou a velocidade das reações direta e inversa são iguais, dizemos que a reação está em equilíbrio químico.
Geralmente, o estudo do equilíbrio químico é feito utilizando-se gráficos que relacionam a velocidade com que os reagentes e/ou os produtos foram consumidos ao passar do tempo, ou seja, relacionam a sua concentração com o tempo.
Em toda reação reversível, a concentração inicial de reagentes é máxima e sua velocidade de consumo também. Conforme vai passando o tempo e os reagentes vão sendo consumidos, a sua concentração diminui e a velocidade da reação direta também diminui. Isso acontece até que a reação atinja o equilíbrio e a concentração dos reagentes permaneça constante:
.jpg)
No caso dos produtos, a sua concentração inicial era zero e a velocidade da reação inversa também. À medida que a reação direta vai ocorrendo, aumenta-se a concentração dos produtos gradativamente. Visto que agora há produtos, a reação inversa também começa a ocorrer, e quanto maior a concentração deles, maior será a velocidade da reação que os consome (inversa). Em determinado momento, então, atinge-se o equilíbrio, em que a concentração dos produtos e a velocidade da reação inversa mantêm-se constantes.

No entanto, apesar de as velocidades das reações direta e inversa serem iguais, a concentração dos reagentes e dos produtos não será a mesma na maioria dos casos. Assim, existem três tipos de gráficos que podem ser usados para representar o equilíbrio químico de acordo com a concentração das espécies envolvidas, que são (1) quando as concentrações dos reagentes e dos produtos são iguais, (2) quando a concentração dos reagentes é inferior à dos produtos e (3) quando a concentração dos reagentes é superior à dos produtos:
(1) Quando as concentrações dos reagentes e dos produtos são iguais:
Nesse caso, o equilíbrio não está deslocado para nenhum lado, a intensidade de ambas as reações é a mesma:

(2) Quando a concentração dos reagentes é inferior à dos produtos:
Nesse caso, já que a concentração dos produtos está maior, isto quer dizer que a reação está deslocada para a direita, porque a reação direta (com formação dos produtos) ocorre com maior intensidade.

(3) Quando a concentração dos reagentes é superior à dos produtos:
Agora ocorre o inverso do caso anterior, o sentido do equilíbrio químico está deslocado para a esquerda, sendo que a reação inversa, com formação dos reagentes, ocorre com maior intensidade e, em virtude disso, a concentração dos reagentes é maior.

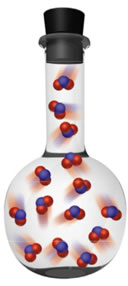
Vamos considerar como exemplo a reação de decomposição do tetróxido de diazoto (N2O4) em dióxido de azoto (NO2):
N2O4(g) ↔ NO2
incolor castanho
Quando observamos os dois frascos na imagem do início do texto, vemos que na primeira situação a reaçaõ está deslocada para a direita, pois o gás dentro do frasco está mais castanho, significando que a concentração do produto [NO2] é maior que a do reagente [N2O4]. Portanto, a representação gráfica do equilíbrio químico nessas condições é feita da seguinte forma:

Já no caso do segundo frasco, temos que a concentração do reagente está igual à do produto, pois a coloração castanha está menos intensa:

Se a coloração castanha fosse bem mais fraca, isso significaria que a concentração do produto [NO2] seria menor que a do reagente [N2O4].