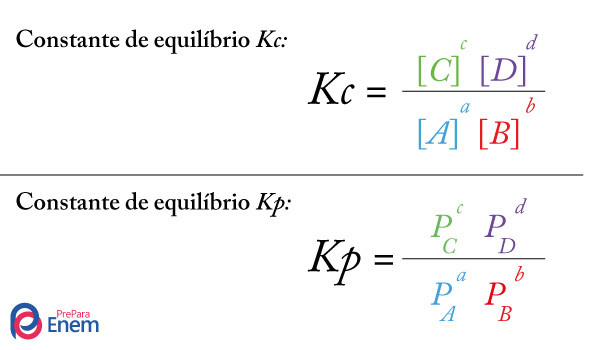Segundo a teoria de Arrhenius, os ácidos são compostos covalentes que reagem com a água, sofrendo ionização, isto é, ocorre a formação de íons que não existiam anteriormente, sendo que apresentam como único cátion o hidrônio (H3O+). Já as bases são compostos capazes de se dissociar na água, ou seja, ocorre a separação dos seus íons que já existiam, dos quais o único ânion é o hidróxido, OH-.
Na realidade, essas reações de ionização dos ácidos e dissociação iônica das bases são reações reversíveis que podem atingir o equilíbrio químico. Isso é mostrado abaixo, considerando um ácido genérico (HA) e uma base genérica (BOH):
HA + H2O(ℓ) ↔ H3O+(aq) + A-(aq)
BOH ↔ B+(aq) + OH-(aq)
Esses são exemplos de equilíbrios iônicos.
“Equilíbrio iônico é todo equilíbrio químico
que envolve a participação de íons.”
A constante de equilíbrio (KC) para os equilíbrios iônicos acima pode ser expressa da seguinte forma:
KC = [H3O+] . [A-] KC = [B+] . [OH-]
[HA] . [H2O] [COH]
Observe que no caso da constante de equilíbrio do ácido aparece a água. Porém, como a água é um líquido, a sua concentração em mol/L não varia, é uma constante. Então, podemos fazer o seguinte:
KC . [H2O] = [H3O+] . [A-]
[HA]
Visto que KC . [H2O] = constante, encontramos uma nova constante, a constante de ionização, que é simbolizada por Ki. Quando se trata de ácidos, a constante de ionização é também simbolizada por Ka, e quando é uma base, ela é simbolizada por Kb. Mas essas são apenas notações diferentes que são utilizadas para designar a mesma constante.
Assim, temos que as constantes de ionização das reações genéricas acima são:
Ki = [H3O+] . [A-] Ki = [B+] . [OH-]
[HA] [COH]
ou
Ka = [H3O+] . [A-] Kb = [B+] . [OH-]
[HA] [COH]
Observe que a constante de ionização é diretamente proporcional à concentração dos íons. Assim, quanto maior for o grau de ionização ou de dissociação (α) dos ácidos e das bases, maior será a constante de ionização. E quanto maior forem os valores das constantes de ionização, mais fortes serão os ácidos ou as bases.
Os valores de Ki podem ser determinados experimentalmente e, dessa forma, podemos identificar qual ácido ou base é forte ou fraca. Por exemplo, considere os equilíbrios iônicos do ácido clorídrico e do ácido fluorídrico abaixo:
HCℓ + H2O(ℓ) ↔ H3O+(aq) + Cℓ-(aq) A 25 ºC e em uma → α = 100%
HF + H2O(ℓ) ↔ H3O+(aq) + F-(aq) solução a 1,0 mol/L → α = 3%
Isso significa que se forem adicionadas 100 moléculas de HCℓ na água, todas irão se ionizar, enquanto de cada 100 moléculas de HF, somente 3 se ionizarão. Isso nos mostra que o HCℓ é um ácido forte, enquanto o HF é um ácido fraco.
Isso é mostrado também pelos seus respectivos valores das constantes de ionização:
Ka(HCℓ) = muito grande (103);
Ka(HF) = 7 . 10-4.