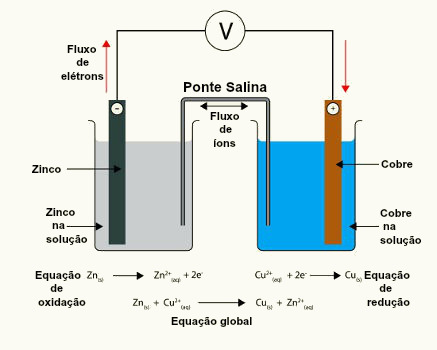
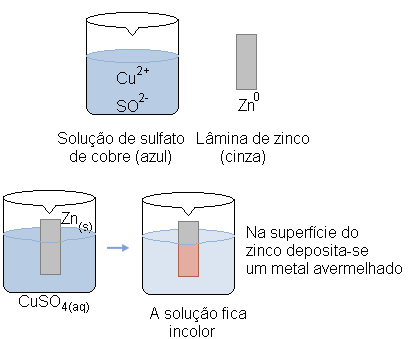
A equação global de uma pilha é a expressão utilizada para representar o fenômeno de oxidação e redução entre os componentes dessa pilha, ou seja, é a representação que permite a identificação do componente da pilha que perde elétrons e do componente que ganha elétrons.
-
Componente que perde elétrons: sofre oxidação (agente redutor);
-
Componente que ganha elétrons: sofre redução (agente oxidante).
Como toda equação química, a equação global de uma pilha possui reagente e produto separados por uma seta. Além disso, os componentes metálicos são escritos com o símbolo (s) de sólido, e os íons, com o símbolo (aq) de aquoso.

Como montar a equação global de uma pilha
-
Passo 1: possuir as equações químicas dos metais utilizados na pilha e os seus respectivos potenciais. Veja como exemplo duas equações de redução:

Equações de redução de alguns metais
-
Passo 2: determinar qual metal sofre oxidação e qual metal sofre redução. Para isso, basta respeitar as equações e os potenciais que foram fornecidos. No exemplo acima, temos duas equações de redução, logo, o Cr+3 sofre redução (por apresentar o maior potencial de redução), e o Zn sofre oxidação (por apresentar o menor potencial de redução).
Por fim, devemos deixar as equações no formato correto de acordo com a determinação acima:

-
Passo 3: igualar a quantidade de elétrons nas duas equações.
Caso a quantidade de elétrons seja diferente nas equações de oxidação e redução, devemos igualá-la multiplicando a equação de cada um por um número inteiro.
No exemplo que estamos utilizando, devemos multiplicar a equação de oxidação por 3 e a equação de redução por 2, pois, desse modo, a quantidade de elétrons em ambas será igual a 6.
.jpg)
O resultado será:

- Passo 4: montagem da equação global da pilha
Para montar a equação global, devemos cancelar as quantidades iguais de elétrons e em lados opostos e somar as equações.

Vale ressaltar que devemos escrever primeiro o componente da oxidação e, depois, o componente da redução.
Exemplos
→ Construção da equação global de uma pilha formada por ferro e estanho

Para montar a equação global, devemos:
1º) Reconhecer que o ferro sofre redução (por ter o maior potencial de redução) e que o estanho oxida-se (por ter o menor potencial de redução). Assim, a equação do estanho no padrão correto é:

2º: Multiplicar a equação do ferro por 2 e a equação do estanho por 3 para que, em ambas, tenhamos 6 elétrons.

3º: Cancelar as quantidades de elétrons iguais e somar as equações.

→ Construção da equação global de uma pilha formada por prata e cobre

1º: Reconhecer que a prata sofre redução (por ter o maior potencial de redução) e que o cobre oxida-se (por ter o menor potencial de redução). Assim, a equação do cobre no padrão correto é:

2º: Multiplicar a equação do cobre por 1 e a equação da prata por 2 para que, em ambas, tenhamos 2 elétrons.

3º: Cancelar as quantidades de elétrons iguais e somar as equações.

Representação da equação global de uma pilha
Metal que sofre oxidação / cátion da oxidação // cátion da redução / metal que sofre redução
OBS.: As duas barras (//) representam a ponte salina da pilha.

X(s) e X+(aq) estão à esquerda por representarem a oxidação, e Y+(aq) e Y(s) estão à direita por representarem a redução:

Exemplos da representação de equações globais de uma pilha
→ Pilha formada por ferro e estanho

A representação da equação global da pilha de ferro (componente que sofre redução) e cobre (componente que se oxida) é:

→ Pilha formada por prata e cobre

A representação da equação global da pilha de prata (componente que sofre redução) e cobre (componente que se oxida) é: