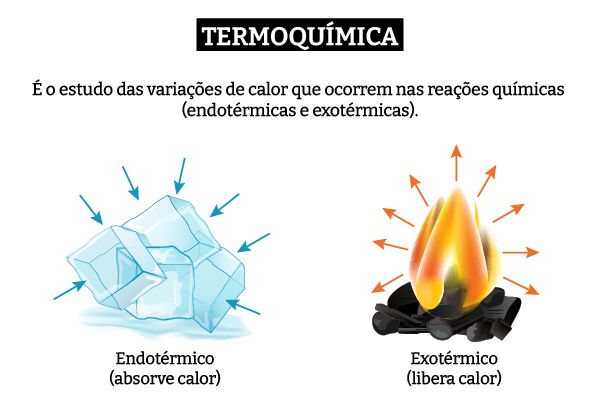
Entalpia (H) é uma grandeza termodinâmica associada à energia interna do sistema. Contudo, em processos isobáricos (que ocorrem sem variação da pressão), a variação da entalpia (∆H) é numericamente igual à quantidade de calor transferida entre sistema e vizinhança. Assim, a entalpia se torna uma ferramenta importante para a Termoquímica, visto que boa parte das reações ocorrem isobaricamente.
A entalpia é geralmente visualizada em termos de sua variação, ∆H. Quando a variação de entalpia é negativa, entende-se que o processo é exotérmico. Do contrário, quando a variação é positiva, entende-se que o processo é endotérmico. Diversos são os processos químicos e físicos que possuem variações de entalpia conhecidas, as quais auxiliam na compreensão de fenômenos.
Leia também: Afinal, o que é a Termoquímica?
Tópicos deste artigo
- 1 - Resumo sobre entalpia
- 2 - Videoaula sobre entalpia
- 3 - O que é entalpia?
- 4 - Variação de entalpia
- 5 - Tipos de entalpia
- 6 - Exercícios resolvidos sobre entalpia
Resumo sobre entalpia
-
Entalpia (H) é uma grandeza termodinâmica que pode ser utilizada para calcular o calor envolvido em transformações que ocorram em pressão constante.
-
É útil para a Termoquímica, pois boa parte das reações químicas ocorrem em pressão constante, assim servindo para medir o calor transferido em reações.
-
Quando a variação de entalpia (∆H) é menor que zero, diz-se que o processo é exotérmico.
-
Quando a variação de entalpia (∆H) é maior que zero, diz-se que o processo é endotérmico.
-
Os processos físicos e químicos possuem variações de entalpia conhecidos, que são as variações de entalpia padrão, úteis para entender o calor envolvido nesses processos.
-
Os tipos de entalpia são entalpias de mudanças físicas e entalpias de mudanças químicas.
Videoaula sobre entalpia
O que é entalpia?
Simbolizada pela letra H, a entalpia é uma grandeza termodinâmica que é utilizada para calcular o calor envolvido em transformações que ocorram em pressão constante (processos isobáricos). Isso porque, segundo as leis da termodinâmica, a variação da entalpia em um processo isobárico é numericamente igual à quantidade de calor transferida entre o sistema e a vizinhança.
Assim sendo, de forma simples:
∆H = Q, em pressão constante.
Vale sempre lembrar, a entalpia não é o calor, nem o conteúdo de calor, muito menos a quantidade de calor do sistema. É uma grandeza termodinâmica, associada à energia interna de um corpo e que, por consequência das mudanças de estado do sistema, apresenta uma variação igual à quantidade de calor transferida.
Variação de entalpia
A Termoquímica é o campo da termodinâmica que estuda as quantidades de energia transferidas na forma de calor durante uma reação química. Vale lembrar que um recipiente com substâncias dentro pode configurar um sistema, e, na maioria das vezes, os processos químicos ocorrem sem variação da pressão. Dessa forma, a entalpia se torna uma ferramenta apta para mensurar a quantidade de calor que foi transferida entre o sistema e a vizinhança. Para uma reação química, temos a seguinte estrutura básica:
Reagentes → Produtos
A variação de entalpia (∆H) para o sistema acima pode ser entendida como ∆H = HP – HR, ou seja, a quantidade da entalpia dos produtos (final) subtraída da quantidade de entalpia dos reagentes (inicial).
Se houve absorção de calor pelo sistema durante a transformação dos reagentes em produtos, é possível dizer que o processo é endotérmico (quando há transferência de calor da vizinhança para o sistema). Porém, como nessas condições da reação é possível afirmar que ∆H = Q, é adequado também afirmar que a entalpia variou de forma positiva e, para fins de simplificação, afirmamos que ∆H > 0 pode ser entendido a reação sendo endotérmica.
Contudo, se houver transferência de calor do sistema para a vizinhança, ou seja, perda de energia, é possível dizer que a reação química é exotérmica. Nessas condições, então, é possível afirmar que a variação da entalpia foi negativa (∆H < 0), e, por isso, simplificadamente, entendemos que, em processos isobáricos, ∆H < 0 pode ser entendido como a reação sendo exotérmica.
Acesse também: Como é feito o cálculo da variação de entalpia (∆H)?
Tipos de entalpia
Os tipos de entalpia são, na verdade, variações de entalpia padrão (∆H°) em alguns processos físicos e químicos. Uma variação de entalpia padrão ocorre quando a variação de entalpia de um processo específico ocorre em condições padrão. Nesse caso, as substâncias devem estar puras, e o processo deve ocorrer em uma dada temperatura e na pressão de 1 bar.
→ Entalpias de mudanças físicas
Em termos de entalpias de mudanças físicas, temos, por exemplo, a entalpia-padrão de vaporização (∆vapH°), que consiste na variação de entalpia que ocorre quando 1 mol de moléculas de um líquido puro na pressão de 1 bar se converte em um gás na pressão de 1 bar:
H2O (l) → H2O (g) ∆vapH° (373 K) = + 40,7 kJ.mol−1
Outro exemplo é a entalpia-padrão de fusão (∆fusH°), que consiste na variação de entalpia que ocorre quando 1 mol de moléculas de um sólido puro é convertido em um líquido puro na pressão de 1 bar, como, por exemplo:
H2O (s) → H2O (l) ∆fusH° (273 K) = + 6,0 kJ.mol−1
O importante é que, com esses valores, é possível determinar a entalpia-padrão de sublimação (a passagem de sólido para gás), uma vez que, como a entalpia é uma função de estado (não avalia o mecanismo da reação, apenas quanto variou o estado final em relação ao inicial), é possível dizer que ∆subH° = ∆vapH° + ∆fusH°. A tabela a seguir lista algumas entalpias-padrão de mudanças físicas:
|
Mudança |
Processo |
Símbolo |
|
Mistura |
pura → mistura |
∆misH° |
|
Solução |
soluto → solução |
∆solH° |
|
Hidratação |
x± (g) → x± (aq) |
∆hidH° |
|
Transição |
fase α → fase β |
∆trsH° |
→ Entalpias de mudanças químicas
Existem algumas reações químicas que apresentam entalpias-padrão. É o caso das reações de combustão e formação.
Nas reações de combustão, um combustível reage com o oxigênio do ar (comburente), produzindo gás carbônico (CO2) e água, se tal combustível for de origem orgânica e se a reação for completa. Toda combustão é exotérmica. Por exemplo, a combustão do metano (CH4) é dada por:
CH4 (l) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
Já nas reações de formação, entende-se que estas são reações em que 1 mol de moléculas de substâncias compostas em estado padrão são formadas a partir de suas substâncias simples mais estáveis em uma dada temperatura e na pressão de 1 bar. Assim, a equação de formação do benzeno (C6H6) na temperatura de 298 K é dada por:
6 C (s, grafite) + 3 H2 (g) → C6H6 (l)
Veja que, nessa temperatura, a forma simples mais estável do carbono é a forma alotrópica grafite, assim como a forma mais estável do hidrogênio é o gás hidrogênio, H2. Convencionou-se que a forma mais estável tem entalpia nula; dessa forma, já que ∆H = HP – HR, se o fator HR é nulo, então a variação de entalpia da reação é justamente a entalpia do produto (∆H = HP). Isso é um recurso interessante, pois, como não se conhece um valor absoluto de entalpia, podem-se usar os valores de entalpia de formação para se referir às diversas substâncias compostas.
A tabela a seguir apresenta os valores das entalpias-padrão de combustão (∆cH°) e formação (∆fH°) de algumas substâncias orgânicas.
|
Substância |
∆fH° (kJ.mol−1) |
∆cH° (kJ.mol−1) |
|
Benzeno, C6H6 (l) |
+ 49,0 |
− 3268 |
|
Etano, C2H6 (g) |
− 84,7 |
− 1560 |
|
Glicose, C6H12O6 (s) |
− 1274 |
− 2808 |
|
Metano, CH4 (g) |
− 74,8 |
− 890 |
|
Metanol, CH3OH (l) |
− 238,7 |
− 721 |
Outra forma de entalpia-padrão muito associada em transformações químicas é a entalpia de ligação (ou entalpia de dissociação de ligação). Ela é entendida como a energia necessária para romper uma ligação em uma molécula. Por exemplo:
H2O (g) → H (g) + OH (g) ∆H = + 941,4 kJ.mol−1
OH (g) → H (g) + O (g) ∆H = + 427 kJ.mol−1
Apesar de a mesma ligação (O─H) ter sido quebrada, os valores de energia foram diferentes para o processo. Isso porque o ambiente químico muda. Assim, ligações O─H em diferentes moléculas apresentariam valores de energia de ligação diferentes. Por isso, o que se usa, na verdade, é uma média das energias de ligação.
As energias de ligação são úteis para determinar a variação de entalpia de uma reação quando valores de entalpia-padrão de formação ou combustão não estão disponíveis. Nesse caso, a variação de entalpia é dada por:
∆H = ΣEL (reagentes) + ΣEL (produtos)
“EL” significa “energia de ligação”. Repare que no caso dos reagentes o movimento é de quebra de ligação, ou seja, endotérmico. Contudo, na formação dos produtos, ocorre justamente o contrário, ou seja, restabelecimento de ligações químicas. Nesse caso, o processo é exotérmico, uma vez que os átomos, ao estabelecerem ligações, perdem energia cinética.
Acesse também: O que é a entropia?
Exercícios resolvidos sobre entalpia
Questão 1
(UERR)
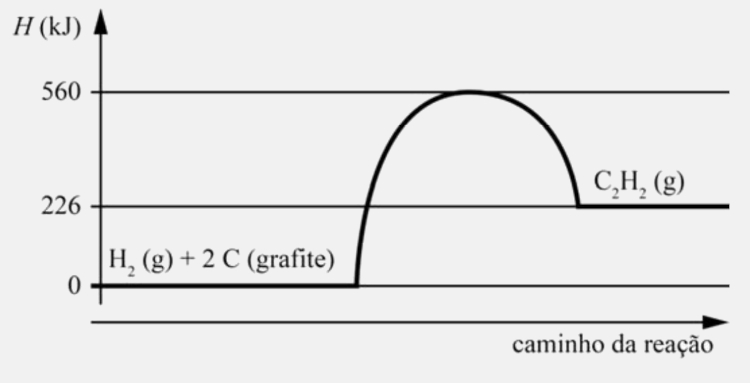
Internet: cursoenemgratuito.com.br (com adaptações).
Infere-se do gráfico precedente, que representa a variação de entalpia (H) na reação de formação do acetileno, que a energia de ativação da reação de decomposição do acetileno é igual a
A) 0 kJ.
B) 226 kJ.
C) 334 kJ.
D) 560 kJ.
E) 786 kJ.
Resolução:
Alternativa B.
Sendo a variação de entalpia dada como ∆H = HP – HR, é possível dizer que:
∆H = 226 – 0
∆H = 226 kJ
Questão 2
(UFRGS) Considere as seguintes afirmações em relação à energia térmica em reações químicas.
I. A formação do cloro atômico, a partir do cloro molecular, é uma reação endotérmica.
II. A reação CaO (s) + H2O (l) → Ca(OH)2 (s) representa a reação de formação do hidróxido de cálcio.
III. O oxigênio, na forma ozônio, possui entalpia de formação nula porque é uma substância pura.
Quais estão corretas?
A) Apenas I.
B) Apenas II.
C) Apenas III.
D) Apenas I e II.
E) I, II e III.
Resolução:
Alternativa A.
I. A formação do cloro atômico, a partir do cloro molecular, é uma reação endotérmica. (correta)
A formação do cloro atômico necessita da quebra da ligação Cl─Cl, um processo endotérmico.
II. A reação CaO (s) + H2O (l) → Ca(OH)2 (s) representa a reação de formação do hidróxido de cálcio. (incorreta)
Uma reação de formação tem a formação de 1 mol da substância composta a partir das substâncias simples mais estáveis em uma dada temperatura.
III. O oxigênio, na forma ozônio, possui entalpia de formação nula porque é uma substância pura. (incorreta)
A forma mais estável do oxigênio é o O2, não o ozônio, O3. Assim, sua entalpia não é nula.
Fontes
ATKINS, P.; PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.
SILVA, J. L. P. B. Por que não estudar entalpia no Ensino Médio. Química Nova na Escola, v. 22. nov. 2005