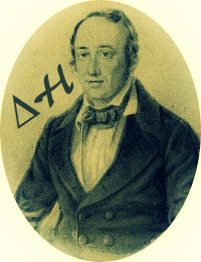As reações de combustão são aquelas em que um composto que é denominado combustível reage com o oxigênio (O2), que é o comburente.
Veja abaixo alguns exemplos de reações de combustão:

Observe que há quatro coisas em comum em todas essas reações:
- Todas têm a participação do oxigênio como comburente;
- Todas possuem 1 mol da substância combustível;
- A combustão é completa, isto é, foram produzidos CO2 e H2O;
- Há a liberação de calor, portanto, são reações exotérmicas com o ∆H negativo (∆H < 0).
Com base nessas conclusões, podemos chegar à seguinte definição:

Podemos também nos referir à entalpia de combustão como ∆H de combustão e calor de combustão. Como se pressupõe que a substância esteja em seu estado padrão, podemos também chamá-la de entalpia-padrão de combustão.
Visto que as equações acima indicam a combustão completa de 1 mol da substância combustível, então é mais correto usar a unidade kJ/mol.
É importante lembrar que a combustão completa só irá produzir CO2 e H2O se a queima for de compostos que possuam apenas carbono e hidrogênio (como hidrocarbonetos) ou carbono, hidrogênio e oxigênio (como álcoois, cetonas, ácidos carboxilícos e aldeídos). Uma combustão incompleta desses compostos produziria monóxido de carbono (CO) ou carbono elementar (C).
Porém, a entalpia de combustão também é dada para outros compostos que sofrem combustão completa e que não produzem exclusivamente CO2 e H2O.
Isso pode ser mostrado pelo exemplo da combustão do hidrogênio:
1 H2(g) + 1/2 O2(g) → 1 H2O(l) ∆H = - 285,8 kJ
1mol
Essa equação indica que houve a liberação de 265,8 kJ na combustão completa de 1 mol de H2(g):