A energia livre de Gibbs é uma grandeza termodinâmica, representada pela letra G, utilizada para prever a espontaneidade do processo químico, em temperatura e pressão constantes. Um processo é dito espontâneo quando a variação da energia livre de Gibbs é menor que zero (ΔG < 0) e não espontâneo quando ela é maior que zero (ΔG > 0).
A energia livre de Gibbs depende das variações de entalpia e entropia, além da temperatura do sistema. Quanto maior a temperatura, menor se torna o valor de ΔG. Outro ponto importante da variação de energia livre de Gibbs é que ela é usada para dizer se um sistema atingiu o equilíbrio químico ou não. Para tal, basta ver se ΔG é igual a zero.
Leia também: O que é a entalpia-padrão?
Tópicos deste artigo
- 1 - Resumo sobre energia livre de Gibbs
- 2 - O que é energia livre de Gibbs?
- 3 - Fórmula da energia livre de Gibbs
- 4 - Espontaneidade de uma reação
- 5 - Como calcular a energia livre de Gibbs?
- 6 - Quando a energia livre de Gibbs é zero?
- 7 - Exercícios resolvidos sobre energia livre de Gibbs
Resumo sobre energia livre de Gibbs
- A energia livre de Gibbs (G) serve para predizer se um processo é espontâneo ou não.
- Essa grandeza depende dos valores da variação de entalpia, da temperatura e da variação de entropia.
- Quando a variação da energia livre de Gibbs (ΔG) for menor que zero, então o processo é espontâneo; do contrário, não é.
- A energia livre de Gibbs também serve para dizer se um sistema atingiu equilíbrio químico ou não, pois, segundo a termodinâmica, quando ΔG = 0, o sistema está em equilíbrio.
O que é energia livre de Gibbs?
A energia livre de Gibbs, comumente representada pela letra G, é uma grandeza termodinâmica utilizada para verificar se uma reação química é espontânea ou não quando a temperatura e a pressão permanecem constantes. O nome dessa grandeza é uma homenagem ao físico norte-americano Josiah Willard Gibbs, que foi protagonista na transformação da termodinâmica em uma área de grade importância científica.
Fórmula da energia livre de Gibbs
A fórmula para a energia livre de Gibbs, em temperatura e pressão constantes, é dada por:
∆G = ∆H - T∆S
Onde ΔH corresponde à variação de entalpia, T é a temperatura do sistema (em Kelvin) e ΔS é a variação da entropia.
Veja também: Como calcular a variação de entalpia
Espontaneidade de uma reação
Um processo é dito espontâneo quando ΔG < 0. Assim sendo, devemos analisar as condições que levam o valor de ΔG a ser negativo. A tabela a seguir apresenta as condicionantes:
|
ΔH |
ΔS |
É espontâneo? (ΔG < 0) |
|
− |
+ |
Sim |
|
− |
− |
Sim, quando |TΔS| < |ΔH| |
|
+ |
+ |
Sim, quando TΔS > ΔH |
|
+ |
− |
Não |
Vale lembrar que a entropia (S) é uma medida da desordem do sistema, enquanto a entalpia (H) é uma grandeza numericamente igual à quantidade de calor do sistema, quando a pressão é constante. Para que ΔG seja cada vez menor (mais negativa ou menos positiva), faz-se necessário uma diminuição da temperatura, pois ΔG = ΔH – TΔS.
Como calcular a energia livre de Gibbs?
Uma boa forma de entender a relação de espontaneidade com essas grandezas é avaliando as mudanças de fase. Por exemplo, um sólido em que as partículas estão mais compactadas apresenta menor grau de desordem, logo uma menor entropia. O líquido, um estado intermediário em que as moléculas já estão mais espaçadas e com maior grau de liberdade de movimentação, apresenta uma entropia ainda maior, a qual vai aumentando com a temperatura, visto que as moléculas adquirem mais energia cinética e a desordem também aumenta.
Com isso chegamos ao gás, em que as interações intermoleculares são quase inexistentes; as moléculas têm alta movimentação e energia cinética, ou seja, os maiores valores de entropia (maior desordem).
Por exemplo, em 10 °C, é mais provável que, na pressão de 1 atmosfera, a água sofra fusão (estando na fase líquida) ou solidificação (estando na fase sólida)? Sabendo que o ΔH°fusão = 6,01 kJ/mol e a ΔS°fusão = 22 J/K.mol, podemos testar as duas suposições. Para a água ser líquida, consideramos que ela sofreu fusão (sólido para líquido), assim a expressão para o ΔG:
∆G = 6,01 kJ/mol - (283K) ∙ (22 ∙ 10-3 kJ/K ∙ mol)
∆G = 6,01 - 6,23 = - 0,22 kJ/mol
Já para a água ser sólida, consideramos que ela deve congelar nessa temperatura e, assim, invertem-se os sinais de ΔH e ΔS, pois estamos falando do processo contrário da fusão (que é a solidificação):
∆G = - 6,01 kJ/mol - (283K) ∙ (- 22 ∙ 10-3 kJ/K ∙ mol)
∆G = - 6,01 + 6,23 = 0,22 kJ/mol
Assim, comprova-se por meio da energia livre de Gibbs que, a 10 °C, a forma mais estável da água é a forma líquida. Analogamente é possível comprovar que a fase gasosa (no caso, vaporização) também não é espontânea nesse contexto. No caso, ΔH°vaporização = 43,9 kJ/mol e ΔS°vaporização = 110,1 J/K.mol. Vejamos o valor da energia livre de Gibbs:
∆G = 43,9 kJ/mol - (283K) ∙ (110,1 ∙ 10-3 kJ/K ∙ mol)
∆G = 43,9 - 31,2 = 12,7 kJ/mol
Ou seja, como esperado, a formação da fase gasosa na temperatura de 10 °C, em 1 atm de pressão, não é espontâneo. Já para uma reação química, o valor de ΔG pode ser calculado por meio do ΔG de reação, em que:
ΔG = Σ G(produtos) – Σ G(reagentes)
Uma das metodologias que utiliza o arquétipo dessa expressão é a do cálculo do ΔG por meio da energia livre de Gibbs de formação (ΔG°f), muito semelhante ao cálculo da entalpia de formação (ΔH°f). No caso, os valores da energia livre das substâncias já são conhecidas. As substâncias simples mais estáveis de cada elemento, na temperatura de 25 °C e pressão de 1 bar, possuem valores iguais a zero (tal qual na entalpia de formação).
Quando a energia livre de Gibbs é zero?
Até então se falou sobre uma variação negativa ou positiva de ΔG, mas ainda não se falou quando ΔG = 0. Para entendermos melhor o que isso significa termodinamicamente, precisamos entender algumas expressões algébricas. A segunda lei da termodinâmica nos diz que a entropia de um sistema isolado aumenta durante uma mudança espontânea. Um sistema isolado é composto pelo sistema em si e a vizinhança.
Assim, a variação total da entropia é dada pelo somatório da variação de entropia do sistema e da variação de entropia da vizinhança:
ΔStotal = ΔS + ΔSvizinhança
Em um processo exotérmico que ocorra dentro do sistema, energia na forma de calor é transferida para a vizinhança, fazendo com que haja um aumento da sua entropia (ΔSvizinhança > 0). No caso de um processo endotérmico, o sistema absorve energia na forma de calor da vizinhança, fazendo sua entropia diminuir (ΔSvizinhança < 0).
Como a vizinhança do sistema é, em geral, muito grande, essa troca de calor não vai resultar em uma alteração de temperatura, assim podemos considerar que a temperatura permanece constante ao longo de todo o processo. A entropia, segundo a termodinâmica, em temperatura constante, pode ser calculada da seguinte forma:
\(\Delta S = \frac{q}{T}\)
Onde “q” é a energia transferida na forma de calor e “T” é a temperatura absoluta do processo. Como para a vizinhança absorver calor é preciso o sistema liberar, é possível dizer que:
q = − qvizinhança
Ou seja, se o sistema liberar 10 kJ de calor (−10 kJ) é porque a vizinhança irá absorver 10 kJ de calor (+10 kJ), e vice-versa. Assim, para o cálculo da variação de entropia da vizinhança temos que:
\(\Delta S_{\text{viz.}} = \frac{-q_{\text{viz.}}}{T}\)
Se todo o processo ocorrer em temperatura constante, então a troca de calor é numericamente igual à variação de entalpia e, assim sendo:
\(\Delta S_{\text{(viz.)}} = \frac{-\Delta H}{T}\)
A expressão anterior só é válida se a pressão e a temperatura permanecem constantes. Portanto, retornando à primeira expressão da variação da entropia total, podemos dizer que:
\(\Delta S_{\text{total}} = \Delta S - \frac{\Delta H}{T} \)
Agora, a partir da equação da energia livre de Gibbs, podemos fazer uma pequena interpretação:
\(\Delta G = \Delta H - T \Delta S\)
Se dividirmos toda a equação pela temperatura, temos:
\(\frac{\Delta G}{T} = \frac{\Delta H}{T} - \Delta S \)
\(\frac{\Delta G}{T} = -\left( \Delta S - \frac{\Delta H}{T} \right) \)
\(\frac {\Delta G}{T} = -\Delta S_{\text{total}} \)
\(∆G=-T∆S_{total} \)
Ou seja, com o sinal negativo é possível perceber que, em temperatura e pressão constantes, um aumento da entropia total do sistema causa uma queda na energia livre de Gibbs.
Para que ΔG seja igual a zero, ΔStotal também deve ser zero (uma vez que a temperatura absoluta, em Kelvin, não será zero). A condição para que a variação de entropia total seja nula é que o sistema não apresente variação no grau de desordem, e só há uma explicação possível: isso vai acontecer quando o sistema estiver em equilíbrio químico.
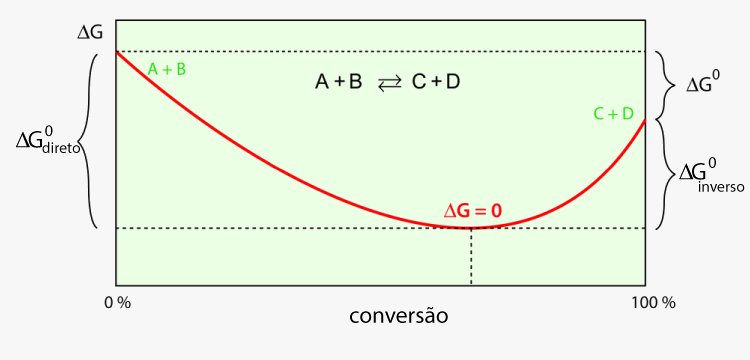
Repare no gráfico a seguir, para o processo hipotético A + B ⇌ C + D. O eixo horizontal marca o nível de conversão da reação, onde, à esquerda, não há produtos (apenas A e B) e, à direita, não há reagentes (apenas C e D). Conforme a reação se desenvolve, dada sua espontaneidade, a entropia total aumenta (pois as moléculas estão reagindo, então a desordem aumenta), ocasionando uma queda de ΔG (ΔG°direto).
Conforme os produtos C e D são formados, a reação inversa também começa a se propagar e, assim, também há aumento da variação da entropia total para essa reação, ocasionando uma queda de ΔG (ΔG°inverso). Chega-se em um ponto de composição do sistema em que ΔG chega a 0. Nesse momento, o equilíbrio foi estabelecido. Aumentar a conversão, seja da reação direta, seja da reação inversa, já não é espontâneo, pois ocasionará um aumento de ΔG.
Por exemplo, é sabido que a 0 °C (273 K) e pressão de 1 atm, água entra em fusão, coexistindo as fases sólida e líquida, ou seja, elas estão em equilíbrio. Isso pode ser comprovado termodinamicamente, por meio do cálculo do ΔG.
Lembrando que ΔH°fusão = 6,01 kJ/mol, ΔS°fusão = 22 J/K.mol
∆G = 6,01kJ/mol - (273K) ∙ (22 ∙ 10-3 kJ/K ∙ mol)
∆G = 6,01 - 6,01 = 0 kJ/mol
Assim sendo, pode-se verificar se um sistema atingiu o equilíbrio fazendo o cálculo de ΔG. Caso o valor seja igual a 0, então é porque o sistema atingiu o equilíbrio.
Saiba mais: Como a temperatura afeta a velocidade de uma reação química?
Exercícios resolvidos sobre energia livre de Gibbs
Questão 1. (UFT Tarde/2023.1) Um grupo de pesquisadores estudou a termodinâmica do conjunto de reações químicas essenciais para a origem da vida, avaliando tanto as reações que liberam energia como reações que absorvem energia. Eles identificaram 400 reações de síntese de biomoléculas essenciais (tais como de aminoácidos, nucleobases e cofatores “vitamínicos”) que precisariam estar presentes no “LUCA” (sigla para “Last Universal Common Ancestor”, último ancestral universal comum, em tradução livre). Entre os resultados mais importantes estavam os valores de energia livre de Gibbs, os quais revelaram que muitas das reações estudadas são espontâneas nas condições encontradas nas chaminés submarinas (vulcões presentes no assoalho oceânico), isto é, em pH e temperatura elevados. Os pesquisadores concluíram que as próprias reações poderiam sustentar o metabolismo do “LUCA”.
Com base nas informações contidas no texto, analise as afirmativas:
- Reações espontâneas sempre apresentam um valor de variação de energia livre de Gibbs negativo.
- Reações que envolvem redução de entropia (ΔS < 0) nunca são espontâneas.
- Reações que envolvem liberação de energia (exotérmicas, ΔH < 0) são sempre espontâneas.
- Uma reação não espontânea pode tornar-se espontânea devido à variação de temperatura.
- No equilíbrio, o valor da energia livre de Gibbs é igual a zero.
Assinale a alternativa CORRETA:
(A) Apenas as afirmativas I, II e III estão corretas.
(B) Apenas as afirmativas II, III e V estão corretas
(C) Apenas as afirmativas I, IV e V estão corretas.
(D) Apenas as afirmativas III, IV e V estão corretas.
Resposta: Letra C.
A afirmativa I está correta, pois um processo será espontâneo se ΔG < 0.
A afirmativa II está errada, pois uma entropia negativa pode gerar um processo espontâneo se o ΔH for suficientemente negativo, superando o valor de TΔS.
A afirmativa III está errada, pois caso o fator TΔS seja negativo e elevado, o valor de ΔG pode ser positivo.
A afirmativa IV está correta. O aumento da temperatura pode tornar o fator TΔS ainda mais negativo, contribuindo para um ΔG < 0.
A afirmativa V está correta. Um equilíbrio é estabelecido quando ΔG = 0.
Questão 2. (Uece 2ª fase 2º dia/2022.1) O químico alemão Fritz Harber (1868–1934), responsável pela produção de explosivos e armas químicas, foi laureado com o Prêmio Nobel de Química (1918) pela síntese do amoníaco.
Considerando a produção de amoníaco dada pela reação 1/2 N2 (g) + 3/2 H2 (g) → NH3 (g) que ocorre na temperatura de 27 °C, cuja entalpia ΔH é –11,04 kcal/mol e tem variação de entropia ΔS de –23,52 cal/mol.K, é correto afirmar que a sua energia livre ΔG é, aproximadamente,
(A) – 18,09 kcal e a reação é espontânea.
(B) – 3,98 kcal e a reação é espontânea.
(C) + 18,09 kcal e a reação não é espontânea.
(D) + 3,98 kcal e a reação não é espontânea.
Resposta: Letra B.
∆G = ∆H - T∆S
∆G = - 11,04 kcal/mol - (300K) ∙ (- 23,52 ∙ 10-3 kcal/K ∙ mol)
∆G = - 11,04 + 7,06 = - 3,98kcal/mol
Créditos da imagem
[1] German Vizulis/ Shutterstock
Fontes
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.