Para que uma reação química ocorra, algumas condições precisam ser satisfeitas. Por exemplo, os compostos precisam entrar em contato e ter afinidade química. Mas, muitas vezes, mesmo entrando em contato e possuindo afinidade química, algumas reações não ocorrem sem que seja dada uma espécie de propulsão.
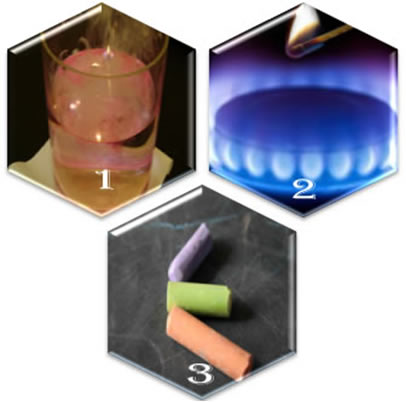
Um exemplo ocorre no caso de abrirmos uma válvula de um fogareiro, deixando que o gás escape. Esse gás não entra em combustão só de entrar em contato com o oxigênio do ar. É preciso aproximar um palito de fósforo aceso para que a reação comece.
Isso acontece porque outra condição necessária para a ocorrência das reações é que os reagentes apresentem energia suficiente, que é chamada energia de ativação (Ea).

O complexo ativado é um estado intermediário entre os reagentes e os produtos, em que as ligações que existem nos reagentes estão sendo enfraquecidas e as ligações dos produtos estão sendo formadas:

No exemplo considerado, os reagentes (gás combustível e oxigênio) possuíam uma energia menor que a energia de ativação de sua reação de combustão. Ao aproximar o palito de fósforo aceso, foi-lhes fornecida a energia para iniciar a reação.
A energia de ativação constitui, portanto, um obstáculo para a ocorrência da reação. Quanto maior for essa energia, mais difícil será para a reação ocorrer e a sua velocidade será menor. Por outro lado, se a energia de ativação de uma reação for pequena, a reação se processará mais rapidamente.
Muitas reações começam assim que os reagentes são postos em contato, isso porque eles já possuem a energia mínima necessária para a ocorrência da reação. Não é preciso que se forneça energia ao sistema.
O valor da energia de ativação varia de reação para reação e a sua forma também. Por exemplo, nem sempre será energia na forma de calor, pode ser também na forma de luz (como na decomposição da água oxigenada), na forma de um atrito (como no acendimento de um fósforo) e assim por diante.
Visto que é considerada como um obstáculo para a ocorrência da reação, geralmente isso é representado por meio de um gráfico, semelhante ao mostrado abaixo:

Pode-se também determinar a energia de ativação (Ea) considerando que ela é a diferença entre a energia necessária para que a reação tenha início (E) e a energia própria contida nos reagentes (Ep):
Ea = E - Ep
- Se a diferença E - Ep for maior que a energia de ativação, a reação será exotérmica, ou seja, os reagentes irão liberar calor.
Ea < E - Ep→ exotérmica
Seu gráfico pode ser representado por:
.jpg)
- Se a diferença E - Ep for menor que a energia de ativação, a reação será endotérmica, ou seja, os reagentes irão absorver calor (será necessário fornecer energia ao sistema para a reação iniciar).
Ea > E - Ep→ endotérmica
Seu gráfico pode ser representado por:
.jpg)